Anonymous
0
0
Công thức tính lượng chất thu được ở điện cực hay nhất (có đáp án 2024) – Hoá học 12
- asked 6 months agoVotes
0Answers
0Views
Công thức tính lượng chất thu được ở điện cực hay nhất – Hoá học lớp 12
Bài tập điện phân là một trong các dạng bài tập thường gặp trong các đề thi. Đa số, các em thường lúng túng và sợ gặp các bài toán liên quan đến điện phân. Bài viết dưới đây, sẽ giúp các em nắm được cách tính khối lượng chất thu được ở điện cực áp dụng vào các bài điện phân cơ bản. Từ đó, làm tiền đề cho các em tiếp cận các bài điện phân nâng cao hơn.
1. Công thức tính lượng chất thu được ở điện cực
- Đối với các bài toán điện phân, khi tính lượng chất thu được ở điện cực sẽ sử dụng công thức định luật Faraday.
- Định luật Faraday: Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất.
- Công thức định luật Faraday:
Trong đó:
m: Khối lượng chất giải phóng ở điện cực, tính bằng gam.
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện, tính bằng ampe (A).
t: Thời gian điện phân, tính bằng giây (s).
F: Hằng số Faraday (96 500 culông/mol).
- Để làm tốt bài tập điện phân, các em có thể tính toán theo phương trình hoặc áp dụng các định luật bảo toàn nguyên tố và bảo toàn electron để giải bài tập.
2. Bạn nên biết
- Tại catot xảy ra sự khử còn anot xảy ra sự oxi hóa.
Ví dụ 1:
Sơ đồ điện phân:
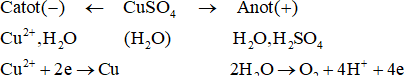
Phương trình điện phân:
![]()
Ví dụ 2:
Sơ đồ điện phân:
![]()
Phương trình điện phân:
![]()
- Những ion bị điện phân trong dung dịch:
3. Mở rộng
Một số kiến thức mở rộng học sinh cần nắm được:
- Biểu thức liên hệ tính số mol electron trao đổi:
với ne là số mol electron trao đổi.
- Bảo toàn số mol electron: Tổng số mol electron catot nhận bằng tổng số electron anot nhường.
- Điều chế kim loại: nguyên tắc là khử ion kim loại thành kim loại.
+ Điện phân nóng chảy dùng điều chế các kim loại như: Na, K, Mg, Ca, Ba, Al.
+ Điện phân dung dịch dùng để điều chế các kim loại trung bình, yếu đứng sau Al trong dãy điện hóa.
4. Bài tập minh họa
Câu 1:
A. 11,7 gam
B. 5,85 gam
C. 23,4 gam
D. 8,775 gam
Hướng dẫn giải
Phương trình:
Đáp án A
Câu 2:
A. 0,64g và 0,112 lít
B. 0,32g và 0,056 lít
C. 0,96g và 0,168 lít
D. 1,28g và 0,224 lít
Hướng dẫn giải
Phương trình điện phân:
![]()
Áp dụng định luật Faraday ta có:
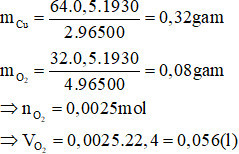
Đáp án B
Câu 3: Điện phân một dung dịch muối MCln với điện cực trơ. Khi ở catot thu được 16 gam kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
A. Mg
B. Fe
C. Cu
D. Ca
Hướng dẫn giải
Phương trình điện phân:
![]()
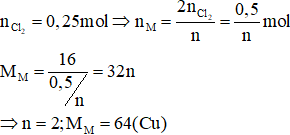
Đáp án C