Anonymous
0
0
50 bài tập về điện phân (có đáp án 2024) – Hoá học 12
- asked 6 months agoVotes
0Answers
0Views
Các dạng bài toán điện phân và cách giải – Hoá học lớp 12
A. Lý thuyết ngắn gọn
a/ Khái niệm : sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực, khi cho dòng điện một chiều đi qua dung dịch chất điện li hoặc chất điện li nóng chảy.
b/ Các quá trình oxi hóa – khử xảy ra ở điện cực :
- Tại catot (cực âm) : xảy ra quá trình khử (quá trình nhận e)

Ví dụ:
Ag+ + 1e → Ag ;
Fe3+ + 1e → Fe2+ ;
Cu2+ + 2e → Cu ;
2H+ + 2e → H2 ;
Fe2+ + 2e → Fe
2H2O + 2e → 2OH– + H2
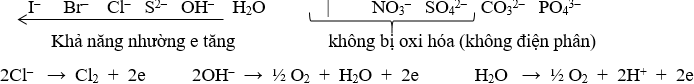
Tại anot (cực dương) : xảy ra quá trình oxi hóa (quá trình nhường e)
c/ Công thức Faraday : tính khối lượng chất thu được tại các điện cực
Trong đó :
m là khối lượng chất thu được ở điện cực (gam)
A là khối lượng mol nguyên tử thu được ở điện cực (gam).
n là số e mà nguyên tử hoặc ion đã cho hoặc nhận.
I là cường độ dòng điện (ampe)
t là thời gian điện phân (giây)
F là hằng số Faraday (F = 96500) / ne là số mol e
d/ Phương pháp điều chế :
- Điện phân nóng chảy : dùng điều chế kim loại mạnh IA , IIA , Al
- Điều chế kim loại nhóm IA : điện phân nóng chảy muối clorua hoặc hidroxit.
Ví dụ 1:
Catot ( – ) ← KCl → Anot (+)
K+ + e → K 2Cl– → Cl2 + 2e
Phương trình điều chế :
2KCl 2K + Cl2
Ví dụ 2:
Catot (–) ← NaOH → Anot (+)
Na+ + e → Na 2OH– → ½ O2 + H2O + 2e
Phương trình điều chế :
2NaOH 2Na + ½ O2 + H2O
Tổng quát:
- Điều chế kim loại nhóm IIA : điện phân nóng chảy muối clorua
Ví dụ 3:
Catot (–) ← MgCl2 → Anot (+)
Mg2+ + 2e → Mg 2Cl– → Cl2 + 2e
Phương trình điều chế :
MgCl2 Mg + Cl2
Tổng quát :
- Điều chế Al : điện phân nóng chảy Al2O3
Catot (–) ← Al2O3 → Anot (+)
Al3+ + 3e → Al 2O2– → O2 + 4e
Phương trình điều chế:
2Al2O3 4Al + 3O2
- Điện phân dung dịch : dùng điều chế kim loại trung bình yếu (sau Al) bằng cách điện phân dung dịch muối của chúng.
Ví dụ 4:
Catot ( – ) ← AgNO3 → Anot (+)
Ag+ , H2O NO3– , H2O
Ag+ + e → Ag H2O → 2H+ + ½ O2 + 2e
Phương trình điều chế :
2AgNO3 + H2O 2Ag + ½ O2 + 2HNO3
Ví dụ 5:
Catot ( – ) ← CuCl2 → Anot (+)
Cu2+ , H2O Cl– , H2O
Cu2+ + 2e → Cu 2Cl– → Cl2 + 2e
Phương trình điều chế :
CuCl2 Cu + Cl2
Chú ý: Khi điện phân các dung dịch sau:
+ Hidroxit của kim loại hoạt động mạnh: KOH, NaOH, Ba(OH)2,..
+ Axit có oxi: HNO3, H2SO4, HClO4,…
+ Muối tạo bởi axit có oxi và bazơ kiềm: KNO3, Na2SO4,…
Thực tế là điện phân H2O sinh ra khí H2 (catot) và khí O2 (anot)
B. Phương pháp giải
Công thức Faraday:
Bước 1: Tính ne trao đổi:
Bước 2:Viết quá trình điện phân.
Bước 3: Tính lượng chất đã điện phân hoặc lượng chất thu được sau điện phân.
Chú ý:
Vkhí = Vkhí (anot) + Vkhí (catot)
mdung dịch giảm = mkim loại + mkhí thoát ra
mcatot = mkim loại (catot)
Chú ý: Nếu biết catot bắt đầu thoát khí → khí thoát ra ở cả hai điện cực. Khi đó nước bắt đầu điện phân ở catot.
2H2O + 2e → 2OH– + H2
C. Ví dụ minh họa
Ví dụ 1:
A. 2,88 gam.
B. 3,84 gam.
C. 2,56 gam.
D. 3,20 gam.
Lời giải chi tiết
Đổi 25 phút 44 giây = 25.60 + 44 = 1544 giây
Theo hệ quả của công thức Faraday:
Quá trình điện phân:
Ở catot (–): Cu2+ + 2e → Cu
0,08 → 0,04 mol
Ở anot (+): 2H2O → O2 + 4H+ + 4e
0,02 ← 0,08 mol
Ta có: mdung dịch giảm = mCu + m
→ mdung dịch giảm = 2,56 + 0,64 = 3,2 gam
Chọn D.
Ví dụ 2:
A. 7,56 gam.
B. 4,32 gam.
C. 8,64 gam.
D. 6,48 gam.
Lời giải chi tiết
Đổi 19 phút 18 giây = 19.60 + 18 = 1158 giây
Theo công thức Faraday:
→ mAg = 6,48 gam
Chọn D.
Ví dụ 3:
A. 250.
B. 1000.
C. 500.
D. 750.
Lời giải chi tiết
Ở catot (–):
Ag+ + 1e → Ag (1)
Cu2+ + 2e → Cu (2)
Nếu Ag+ điện phân hết, Cu2+ chưa điện phân: mkim loại = mAg = 0,01.108 = 1,08 gam
Nếu Ag+ và Cu2+ đều điện phân hết: mkim loại = mAg + mCu = 0,01.108 + 0,02.64 = 2,36 gam
Ta thấy: 1,08 < 1,72 < 2,36 → Ag+ điện phân hết, Cu2+ điện phân một phần
Ta có: mCu = mkim loại – mAg = 1,72 – 1,08 = 0,64 gam
→ nCu = 0,01 mol
Theo (1) và (2): ne trao đổi = nAg + 2nCu = 0,01 + 2.0,01 = 0,03 mol
Chọn D.
D. Bài tập tự luyện
Câu 1:
A. 1,12 lít.
B. 0,56 lít.
C. 3,36 lít.
D. 2,24 lít.
Câu 2:
A. 55,34.
B. 63,46.
C. 53,42.
D. 69,87.
Câu 3:
A. 1,00.
B. 1,20.
C. 0,50.
D. 0,25.
Câu 4:
A. Mg.
B. Fe.
C. Cu.
D. Ca.
Câu 5:
A. 3,2 gam
B. 12,8 gam
C. 16,0 gam
D. 20,0 gam
Câu 6:
A. 4,48 lít.
B. 2,24 lít.
C. 1,12 lít.
D. 1,68 lít.
Câu 7:
A. 15,1 gam.
B. 6,4 gam.
C. 7,68 gam.
D. 9,6 gam.
Câu 8:
A. 3,2 gam và 2000s
B. 2,2 gam và 800s
C. 6,4 gam và 3600s
D. 5,4 gam và 800s
Câu 9:
A. CuSO4
B. NiSO4
C. MgSO4
D. ZnSO4
Câu 10:
A. 4,05
B. 2,70
C. 1,35
D. 5,40
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
D |
B |
A |
C |
C |
D |
C |
A |
D |
B |