Anonymous
0
0
50 bài tập về dãy điện hóa của kim loại (có đáp án 2024) – Hoá học 12
- asked 6 months agoVotes
0Answers
0Views
Bài tập về dãy điện hóa của kim loại và cách giải – Hoá học lớp 12
A. Lý thuyết ngắn gọn
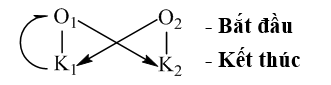
1. Cặp oxi hóa - khử của kim loại :
![]()
2. Dãy điện hóa của kim loại:

3. So sánh tính chất của các cặp oxi hóa – khử :
** Thí dụ 1 :
Cho đinh sắt vào dung dịch CuSO4 : Fe + Cu2+ → Fe2+ + Cu
Ngược lại, cho Cu vào dung dịch FeSO4 : không phản ứng .
→ kết luận : Fe có tính khử mạnh hơn Cu ; Cu2+ có tính oxi hóa mạnh hơn Fe2+ .
** Thí dụ 2 :
Cho Cu vào dung dịch AgNO3 : Cu + 2Ag+ → Cu2+ + 2Ag
Ngược lại : cho Ag vào dung dịch Cu(NO3)2 : không phản ứng.
→ kết luận : tính khử Cu > Ag ; tính oxi hóa Ag+ > Cu2+
Từ 2 thí dụ trên :
Tính khử Fe > Cu > Ag;
Tính oxi hóa Fe2+ < Cu2+ < Ag+
4. Ý nghĩa dãy điện hóa của kim loại:
- Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại (tính oxi hóa của ion Mn+ càng yếu thì tính khử của kim loại M càng mạnh).
- Dự đoán chiều của phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn (quy tắc α ).
Thí dụ: phản ứng giữa 2 cặp Ag+ /Ag và Cu2+ /Cu là:
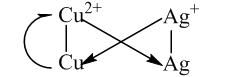
Cu + 2Ag+ → Cu2+ + 2Ag
Khử mạnh oxh mạnh oxh yếu khử yếu
B. Các dạng bài
Dạng 1: Kim loại tác dụng với nước
1.Phương pháp giải
– Lưu ý:
a. Kim loại mạnh : nhóm IA và IIA (trừ Be không khử được nước, Mg khử chậm). Các kim loại còn lại khử mạnh nước ở nhiệt độ thường, giải phóng khí H2 .
2M + 2nH2O → 2M(OH)n + nH2
Ví dụ:
2Na + 2H2O → 2NaOH + H2
Ca + H2O → Ca(OH)2 + H2
Ví dụ:
3Fe + 4H2O Fe3O4 + 4H2
– Để giải các bài tập có thể viết phương trình và tính theo phương trình. Hoặc áp dụng định luật bảo toàn nguyên tố,bảo toàn electron, bảo toàn khối lượng.
2. Ví dụ minh họa
Ví dụ 1:
A. 5,31%.
B. 5,20%.
C. 5,30%.
D. 5,50%
Lời giải chi tiết
Theo giả thiết:
Phương trình hóa học:
2K + 2H2O 2KOH + H2
Theo phương trình:
Áp dụng định luật bảo toàn khối lượng:
![]()
Nồng độ phần trăm của dung dịch KOH là:
Chọn C.
Ví dụ 2:
A. 0,23 gam.
B. 0,46 gam.
C. 1,15 gam.
D. 0,276 gam.
Lời giải chi tiết
Gọi số mol của Na là x mol
→ nNaOH = x mol
Dung dịch thu được có pH = 13
→ pOH = 14 – 13 = 1 → [OH –] = 10-1 = 0,1M
→ x + 0,04 = 0,1.0,5
→ x = 0,01
→ mNa = 0,23 gam
Chọn A.
Dạng 2: Kim loại tác dụng với axit HCl, H2SO4 loãng
1. Phương pháp giải
Viết phương trình hóa học và tính theo phương trình hóa học.
Kim loại + HCl/H2SO4 loãng → muối + H2
Chú ý:
Ngoài ra có thể áp dụng các định luật bảo toàn:
+ Bảo toàn nguyên tố H:
→ hỗn hợp hai axit:
+ Bảo toàn khối lượng:
mkim loại + m+ maxit = mmuối
và mmuối = mkim loại + mgốc axit
+ Bảo toàn electron: ne nhường = ne nhận
2. Ví dụ minh họa
Ví dụ 1:
A. 5,60.
B. 1,12.
C. 2,80.
D. 1,40.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
Chọn C.
Ví dụ 2:
A. 30,4.
B. 15,2.
C. 22,8.
D. 20,3.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
Chọn A.
Dạng 3: Kim loại tác dụng với muối
1. Phương pháp giải
Viết phương trình hóa học theo thứ tự phản ứng (nếu nhiều kim loại, nhiều muối phản ứng) và tính theo phương trình hóa học.
+ Kim loại mạnh (Kim loại kiềm, Ca, Ba): Ban đầu kim loại tác dụng với nước
Kim loại + H2O → kiềm + H2
Sau đó kiềm tác dụng với dung dịch muối
Kiềm + muối → sản phẩm (điều kiện: có kết tủa, bay hơi hoặc chất điện ly yếu)
+ Các kim loại trung bình và yếu: Kim loại đứng trước đẩy kim loại đứng sau khỏi dung dịch muối.
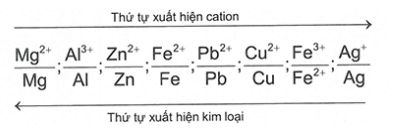
Chú ý: Các trường hợp cần nhớ:
Muối Fe2+ tác dụng được với muối Ag+
Fe2+ + Ag+ → Fe3+ + Ag
Fe tác dụng với muối Fe3+ thì tạo ra muối Fe2+
Fe + 2Fe3+ → 3Fe2+
Ngoài ra có thể áp dụng phương pháp tăng giảm khối lượng, bảo toàn electron.
2. Ví dụ minh họa
Ví dụ 3:
A. 9,8.
B. 14,7.
C. 4,9.
D. 12,0.
Lời giải chi tiết
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2 (1)
2K + 2H2O → 2KOH + H2 (2)
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 (3)
CuSO4 + 2KOH → Cu(OH)2 + K2SO4 (4)
Cu(OH)2 CuO + H2O (5)
Theo (1) và (2) ta có:
Theo (3) và (4) ta có:
Theo (5) ta có:
→ mC = mCuO = 0,15.80 = 12 gam
Chọn D.
Ví dụ 2:
A. 5,6.
B. 11,2.
C. 16,8.
D. 22,4.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
→ m = mFe = 0,2.56 = 11,2 gam
Chọn B.
C. Bài tập tự luyện
Câu 1:
A. Na.
B. Li.
C. Rb.
D. K.
Câu 2:
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Câu 3:
A. K.
B. Na.
C. Li.
D. Rb.
Câu 4:
A. 6,72
B. 4,48
C. 3,36
D. 2,24
Câu 5:
A. 3,2
B. 1,6
C. 4,8
D. 6,4
Câu 6:
A. Li
B. Na
C. K
D. Rb
Câu 7:
A. Li
B. Na
C. K
D. Rb
Câu 8:
A. Fe.
B. Mg.
C. Zn.
D. Ca.
Câu 9:
A. 54,0%.
B. 49,6%.
C. 27,0%.
D. 48,6%.
Câu 10:
A. 9,27.
B. 5,72.
C. 6,85.
D. 6,48.
Câu 11:
A. 4,48 lít.
B. 3,92 lít.
C. 2,08 lít.
D. 3,36 lít.
Câu 12:
A. 4,48.
B. 2,24.
C. 3,36.
D. 1,12.
Câu 13:
A. 7,84.
B. 8,96.
C. 6,72.
D. 10,08.
Câu 14:
A. 2,8 gam.
B. 5,6 gam.
C. 8,4 gam.
D. 1,6 gam.
Câu 15:
A. 2,0.
B. 0,2.
C. 1,0.
D. 0,1.
Câu 16:
A. 4,48.
B. 3,28.
C. 4,72.
D. 4,08.
Câu 17:
A. 23,61.
B. 12,16.
C. 20,16.
D. 21,06.
Câu 18:
A. tăng 0,025 gam so với ban đầu.
B. giảm 0,025 gam so với ban đầu.
C. giảm 0,1625 gam so với ban đầu.
D. tăng 0,16 gam so với ban đầu.
Câu 19:
A. 0,64 gam.
B. 1,28 gam.
C. 1,92 gam.
D. 2,56 gam.
Câu 20:
A. 1,0.
B. 1,5.
C. 2,0.
D. 0,5.
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
D |
B |
B |
C |
A |
A |
A |
B |
A |
A |
Câu 11 |
Câu 12 |
Câu 13 |
Câu 14 |
Câu 15 |
Câu 16 |
Câu 17 |
Câu 18 |
Câu 19 |
Câu 20 |
|
D |
B |
A |
D |
A |
C |
D |
B |
C |
C |