Anonymous
0
0
50 bài tập về phản ứng nhiệt nhôm (có đáp án 2024) – Hoá học 12
- asked 6 months agoVotes
0Answers
0Views
Bài tập về phản ứng nhiệt nhôm và cách giải – Hoá học lớp 12
A. Lý thuyết ngắn gọn
- Al khử được oxit của các kim loại đứng sau nó (oxit sắt, oxit crom,…):
2yAl + 3FexOy yAl2O3 + 3xFe
B. Phương pháp giải
Phương trình hóa học:
2yAl + 3MxOy yAl2O3 + 3xM
Với M là kim loại đứng sau Al trong dãy điện hóa
→ Hỗn hợp sau phản ứng nhiệt nhôm hoàn toàn gồm Al2O3, M và Al dư hoặc Al2O3, M và MxOy dư.
- Bước 1: Xác định chất hết, chất dư
- Nếu hỗn hợp sau phản ứng tác dụng với NaOH sinh ra khí H2, chứng tỏ có Al dư
- Nếu hỗn hợp sau phản ứng gồm hai kim loại, chứng tỏ có M dư
- Nếu hỗn hợp sau phản ứng cho tác dụng với dung dịch axit thu được khí H2, thì chưa thể xác định Al dư hay MxOy dư.
- Bước 2: Tính toán theo yêu cầu bài toán
Chú ý:
- Nếu Al dư, khi đó có Al2O3 và Al phản ứng với dung dịch kiềm, các kim loại còn lại (trừ Zn) không phản ứng
2Al + 2OH– + 2H2O 2AlO2– + 3H2
Al2O3 + 2OH– 2AlO2– + H2O
Ta luôn có:
- Sử dụng các định luật bảo toàn: Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn electron để giải nhanh.
C. Ví dụ minh họa
Ví dụ 1:
A. 0,540.
B. 1,755.
C. 1,080.
D. 0,810.
Lời giải chi tiết
Cho sản phẩm sau phản ứng hoàn toàn tác dụng với dung dịch NaOH dư thu được khí H2
→ Al còn dư sau phản ứng nhiệt nhôm
→ Tính toán theo số mol Fe2O3
Phương trình hóa học:
Ta có:
→ nAl ban đầu = nAl phản ứng + nAl dư = 0,02 + 0,02 = 0,04 mol
→ m = 0,04.27 = 1,08 gam
Chọn C.
Ví dụ 2: Thực hiện phản ứng nhiệt nhôm m gam hỗn hợp X gồm Al và Fe3O4, thu được hỗn hợp Y. Cho Y vào dung dịch NaOH dư, thu được 6,72 lít khí. Mặt khác, nếu cho Y vào dung dịch HCl dư thì thu được 26,88 lít khí. Giá trị của m là
A. 136,8.
B. 91,2.
C. 69,6.
D. 96,6.
Lời giải chi tiết
Ta có sơ đồ:
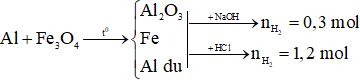
Xét Y + NaOH dư:
Xét Y + HCl dư:
Bảo toàn electron:
Bảo toàn nguyên tố Fe:
Bảo toàn nguyên tố O:
Bảo toàn nguyên tố Al:
→ m = 0,3.232 + 1.27 = 96,6 gam
Chọn D.
Ví dụ 3:
A. 0,9.
B. 1,3.
C. 0,5.
D. 1,5.
Lời giải chi tiết
Ta xét trong mỗi phần (23,3 gam)
Xét phần một + NaOH:
Ta có sơ đồ:
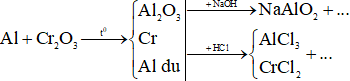
Ta có:
Mặt khác:
Xét phần hai + HCl:
Bảo toàn nguyên tố Al:
Bảo toàn nguyên tố Cr:
Bảo toàn nguyên tố Cl:
Chọn B.
D. Bài tập tự luyện
Câu 1:
A. 16,6 gam.
B. 11,2 gam.
C. 5,6 gam.
D. 22,4 gam.
Câu 2:
A. Al, Fe, Fe3O4 và Al2O3.
B. Al2O3, Fe và Fe3O4.
C. Al2O3 và Fe.
D. Al, Fe và Al2O3.
Câu 3:
A. 32,58
B. 33,39
C. 31,97
D. 34,10
Câu 4:
A. 1,8 gam
B. 12,2 gam
C. 22,4 gam
D. 10,4 gam
Câu 5:
A. FeO và 14,52
B. Fe3O4 và 13,20
C. Fe2O3 và 14,52
D. Fe3O4 và 14,52
Câu 6:
A. 45,6
B. 48,3
C. 36,7
D. 57,0
Câu 7:
A. 10,08
B. 4,48
C. 3,36
D. 7,84
Câu 8:
A. 93,75%
B. 90,25%
C. 82,50%
D. 75,00%
Câu 9:
A. 0,14
B. 0,08
C. 0,16
D. 0,06
Câu 10:
A. 33,61%
B. 42,32%
C. 66,39%
D. 46,47%
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
A |
D |
C |
B |
D |
B |
D |
A |
B |
D |