Anonymous
0
0
Giải Hóa 11 Bài 19: Luyện tập tính chất của cacbon, silic và hợp chất của chúng
- asked 6 months agoVotes
0Answers
0Views
Mục lục Giải Hóa 11 Bài 19: Luyện tập tính chất của cacbon, silic và hợp chất của chúng
Video giải Hóa 11 Bài 19: Luyện tập tính chất của cacbon, silic và hợp chất của chúng
Bài 1 trang 86 Hóa 11: Nêu các điểm giống và khác nhau về tính chất giữa cacbon đioxit và silic đioxit ?
Lời giải:
Giống nhau: đều là oxit axit
CO2 + 2NaOH → Na2CO3 + H2O
SiO2 tan chậm trong kiềm đặc nóng, tan dễ trong kiềm nóng chảy:
SiO2 + 2NaOHnóng chảy Na2SiO3 + H2O
- Khác nhau:
CO2 |
SO2 |
|
- Tính chất vật lí: + Chất khí không màu + Tan ít trong nước - Tính chất hóa học: + Có tính oxi hóa CO2 + 2Mg C + 2MgO |
- Tính chất vật lí: + Chất rắn + Không tan trong nước - Tính chất hóa học. + Tan trong axit HF SiO2 + HF → SiF4 + 2H2O |
Bài 2 trang 86 Hóa 11: Phản ứng hóa học không xảy ra ở những cặp chất nào sau đây ?
Lời giải:
Đáp án a, c, e, h
Phương trình hóa học của những có tham gia phản ứng:
b. CO2 + 2NaOH → Na2CO3 + H2O
(Hoặc CO2 + NaOH → NaHCO3)
d. H2CO3 + Na2SiO3 → Na2CO3 + H2SiO3 ↓
g. 2Mg + CO2 C + 2MgO
i. Si + 2NaOH + H2O → Na2SiO3 + 2H2
Bài 3 trang 86 Hóa 11: Có các chất sau: CO2, Na2CO3, C, NaOH, Na2SiO3, H2SiO3. Hãy lập thành một dãy chuyển hóa giữa các chất và viết phương trình hóa học.
Lời giải:
C → CO2 Na2CO3
NaOH Na2SiO3
H2SiO3
1. C + O2 CO2
2. CO2 + 2NaOH → Na2CO3 + H2O
3. Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
4. SiO2 + 2NaOHđặc, nóng → Na2SiO3 + H2O
5. Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Bài 4 trang 86 Hóa 11: Cho 5,94 g hỗn hợp K2CO3 và Na2CO3 tác dụng với dung dịch H2SO4 dư thu được 7,74 g hỗn hợp các muối khan K2SO4 và Na2SO4. Thành phần hỗn hợp đầu là:
A. 3,18 g Na2CO3 và 2,76 g K2CO3
B. 3,81 g Na2CO3 và 2,67 g K2CO3
C. 3,02 g Na2CO3 và 2,25 g K2CO3
D. 4,27 g Na2CO3 và 3,82 g K2CO3
Lời giải:
Đáp án A
Gọi số mol của Na2CO3 là x và của K2CO3 là y mol
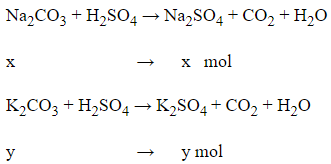
Ta có hệ phương trình:
→
= 106.0,03 = 3,18 gam
= 138.0,02 = 2,76 gam
Bài 5 trang 86 Hóa 11: Để đốt cháy 6,80g hỗn hợp X gồm hiđro và cacbon monooxit cần 8,96 lít oxi (đo ở đktc). Xác định thành phần phần trăm theo thể tích và theo khối lượng của hỗn hợp X?
Lời giải:
= 8,96 : 22,4 = 0,4 mol
Gọi số mol của H2 là x, của CO là y mol
Theo phương trình ta có:
→
%VCO = %nCO = 100 – 75 = 25%
%mCO =
Bài 6 trang 86 Hóa 11: Một loại thủy tinh có thành phần hóa học được biểu diễn bằng công thức K2O.PbO.6SiO2. Tính khối lượng K2CO3, PbCO3 và SiO2 cần dùng để có thể sản xuất được 6,77 tấn thủy tinh trên. Coi hiệu suất qua trình là 100%.
Lời giải:
Số mol thuỷ tinh là:
Từ công thức của thuỷ tinh suy ra:
= nthuỷ tinh = 0,01.106 mol
Khối lượng K2CO3
= 0,01. 106. 138 (g)
= 1,38. 106 (g) = 1,38 (tấn)
Khối lượng PbCO3 = 0,01. 106. 267 (g)
= 2,67. 106 (g) = 2,67 (tấn)
= 6.nthuỷ tinh
= 6. 0,01. 106 mol = 0,06. 106 mol
Khối lượng SiO2 = 0,06. 106. 60 (g) = 3,6 tấn