Anonymous
0
0
Giải Hóa 11 Bài 12: Phân bón hóa học
- asked 6 months agoVotes
0Answers
0Views
Mục lục Giải Hóa 11 Bài 12: Phân bón hóa học
Video giải Hóa 11 Bài 12: Phân bón hóa học
Bài 1 trang 58 Hóa 11: Cho các mẫu phân đạm sau đây: amoni sunfat, amoni clorua, natri nitrat. Hãy dùng các thuốc thử thích hợp để phân biệt chúng. Viết phương trình hóa học của các phản ứng đã dùng?
Lời giải:
Hoà tan mẫu thử của từng phân đạm vào nước thì được 3 dung dịch muối: (NH4)2SO4, NH4Cl, NaNO3. Cho từ từ dung dịch Ba(OH)2 vào từng dung dịch:
- Nếu thấy dung dịch nào có khí bay ra có mùi khai và xuất hiện kết tủa trắng là (NH4)2SO4
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑+ 2H2O
- Nếu thấy dung dịch nào có khí bay ra có mùi khai là NH4Cl
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑+ 2H2O
- Dung dịch không có hiện tượng gì là NaNO3
Bài 2 trang 58 Hóa 11:Từ không khí, than, nước và các chất xúc tác cần thiết, hãy lập sơ đồ điều chế phân đạm NH4NO3.
Lời giải:
Chưng cất phân đoạn không khí lỏng được N2 và O2.
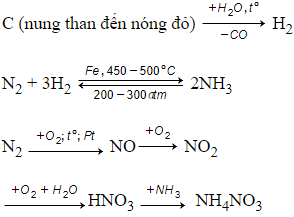
Bài 3 trang 58 Hóa 11: Một loại quặng photphat có chứa 35% Ca3(PO4)2. Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên.
Lời giải:
Trong 1000 gam quặng có:
1000. 35% = 350 gam Ca3(PO4)2
Bảo toàn nguyên tố P → Trong 1 mol Ca3(PO4)2 có 1 mol P2O5 nghĩa là trong 310 gam Ca3(PO4)2 tương ứng có 142 gam P2O5.
→ 350 gam Ca3(PO4)2 có lượng P2O5 là:
= = 160,3 gam
%P2O5 trong quặng =
= 16,03%
Bài 4 trang 58 Hóa 11: Để sản xuất một lượng phân bón amophot đã dùng hết 6,000.103 mol H3PO4.
b) Tính khối lượng amophot thu được.
Lời giải:
Phương trình phản ứng:
H3PO4 + NH3 → NH4H2PO4
H3PO4 + 2NH3 → (NH4)2HPO4
→ Phương trình phản ứng tổng hợp:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
a) Từ phương trình phản ứng ta có:
∑số mol NH3 cần dùng
= 1,5 số mol H3PO4
= 1,5.6.103 = 9000 mol
→ (đktc) = 9000.22,4
= 201600 lít
b) Từ phương trình phản ứng ta có:
=
= 0,5. = 0,5.6.103 = 3000 mol
Khối lượng amophot thu được:
+
= 3000.(115+132)
= 741000 gam = 741 kg