Anonymous
0
0
Giải Hóa 11 Bài 11: Axit photphoric và muối photphat
- asked 6 months agoVotes
0Answers
0Views
Mục lục Giải Hóa 11 Bài 11: Axit photphoric và muối photphat
Video giải Hóa 11 Bài 11: Axit photphoric và muối photphat
Bài 1 trang 53 Hóa 11: Viết phương trình hoá học dạng phân tử và dạng ion rút gọn của phản ứng giữa axit photphoric với lượng dư của:
Lời giải:
Các chất lấy dư nên muối tạo ra là muối trung hoà:
a) Phương trình hóa học dạng phân tử:
2H3PO4 + 3BaO → Ba3(PO4)2 + 3H2O
Phương trình phân tử trùng với phương trình ion thu gọn
b) Phương trình hóa học dạng phân tử:
2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 ↓+ 6H2O
Phương trình hóa học dạng ion rút gọn:
2H3PO4 + 3Ca2+ + 6OH- → Ca3(PO4)2 + 6H2O
c) Phương trình hóa học dạng phân tử:
2H3PO4 + 3K2CO3 → 2K3PO4 + 3H2O + 3CO2↑
Phương trình hóa học dạng ion rút gọn:
2H3PO4 + 3CO32- → 2PO43- + 3H2O + CO2↑
Bài 2 trang 53 Hóa 11: Nêu những điểm giống nhau và khác nhau về tính chất hoá học giữa axit nitric và axit photphoric. Dẫn ra những phản ứng hoá học để minh hoạ?
Lời giải:
- Những tính chất chung: Đều có tính axit
+ Chuyển màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
+ Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Tác dụng với một số muối của axit yếu và không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
- Những tính chất khác nhau:
HNO3 |
H3PO4 |
|
- Axit HNO3 là axit mạnh HNO3 → H+ + NO3- - Axit HNO3 có tính oxi hoá mạnh Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O S + 2HNO3 → H2SO4 + 2NO 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O |
- Axit H3PO4 là một axit trung bình H3PO4 ⇆ H+ + H2PO4- H2PO4- ⇆ H+ + HPO42- HPO42- ⇆ H+ + PO43- - Axit H3PO4 không có tính oxi hoá. 3Fe + 2H3PO4 → Fe3(PO4)2 + 3H2 S + H3PO4 → không phản ứng 3FeO +2H3PO4 → Fe3(PO4)2 + 3H2O |
Bài 3 trang 54 Hóa 11: Phương trình điện li tổng cộng của H3PO4 trong dung dịch là:
A. Cân bằng trên chuyển dịch theo chiều thuận.
B. Cân bằng trên chuyển dịch theo chiều nghịch.
C. Cân bằng trên không bị dịch chuyển.
Lời giải:
Đáp án B.
Khi thêm HCl vào làm tăng nồng độ H+ trong dung dịch. Theo nguyên lí chuyển dịch cân bằng, cân bằng chuyển dịch theo chiều làm giảm nồng độ H+
→ Cân bằng chuyển dịch theo chiều nghịch.
Bài 4 trang 54 Hóa 11: Lập các phương trình hóa học sau đây:
Lời giải:
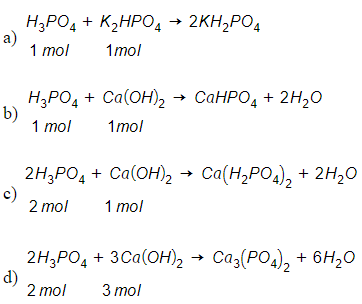
Bài 5 trang 54 Hóa 11: Để thu được muối photphat trung hoà, cần lấy bao nhiêu ml dung dịch NaOH 1,00M cho tác dụng với 50,0ml H3PO4 0,50M?
Lời giải:
Ta có: = 0,05.0,5 = 0,025 mol
Phương trình phản ứng:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
Từ phương trình phản ứng suy ra:
nNaOH = 3
= 3. 0,025 = 0,075 mol
→ VNaOH =
lít = 75 ml