Anonymous
0
0
Lý thuyết Axit photphoric và muối photphat (mới 2023 + Bài Tập) - Hóa học 11
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 11 Bài 11: Axit photphoric và muối photphat
Bài giảng Hóa 11 Bài 11: Axit photphoric và muối photphat
A. Axit photphoric H3PO4
I. Cấu tạo phân tử
- Công thức cấu tạo:
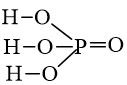
- Trong hợp chất H3PO4, photpho có số oxi hóa cao nhất là +5.
II. Tính chất vật lí
- Là chất rắn dạng tinh thể trong suốt, nóng chảy ở 42,5ºC, rất háo nước nên dễ chảy rữa và tan vô hạn trong nước.
- Axit photphoric thường dùng là dung dịch đặc, sánh, không màu, có nồng độ 85%.
III. Tính chất hóa học
Khác với axit nitric, axit photphoric không có tính oxi hóa.
1. Axit photphoric là axit ba nấc
- Trong dung dịch nước, axit photphoric phân li theo từng nấc:
Nấc 1:
Nấc 2:
Nấc 3:
- Sự phân li chủ yếu xảy ra theo nấc 1, nấc 2 kém hơn và nấc 3 rất yếu.
- Như vậy trong dung dịch axit photphoric có các ion: và các phân tử H3PO4 không phân li (không kể các ion H+ và OH- do nước phân li ra).
2. Axit photphoric có độ mạnh trung bình
- Dung dịch axit photphoric có những tính chất chung của axit như làm quỳ tím hóa đỏ, tác dụng với oxit bazơ, bazơ, muối, kim loại.
Lưu ý: Khi tác dụng với dung dịch kiềm, tùy theo lượng chất tác dụng mà axit photphoric tạo ra muối trung hòa, muối axit hoặc hỗn hợp muối.
Thí dụ:
H3PO4+NaOH→NaH2PO4+H2O
H3PO4+2NaOH→Na2HPO4+2H2O
H3PO4+3NaOH→Na3PO4+3H2O
IV. Ứng dụng và điều chế
1. Ứng dụng
- Một lượng lớn axit photphoric dùng để điều chế các muối photphat và sản xuất phân lân, thuốc trừ sâu,…

Hình 1: Phân lân nung chảy dạng viên
- Axit H3PO4 tinh khiết được dùng trong công nghiệp dược phẩm.
2. Điều chế
a) Trong phòng thí nghiệm
P+5HNO3đặcH3PO4+H2O+5NO2
b) Trong công nghiệp
+ Cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit:
Ca3(PO4)2+3H2SO4đặc3CaSO4↓+2H3PO4
→ Điều chế bằng phương pháp này không tinh khiết và lượng chất thấp.
+ Để điều chế H3PO4 có độ tinh khiết và nồng độ cao hơn người ta đốt cháy P để được P2O5, rồi cho P2O5 tác dụng với nước:
4P+5O22P2O5
P2O5+3H2O→2H3PO4
B. MUỐI PHOTPHAT
Axit photphoric tác dụng với dung dịch kiềm, tạo ra 3 loại muối:
- Muối photphat trung hòa: Na3PO4, Ca3(PO4)2, …
- Muối đihiđrophotphat: NaH2PO4, Ca(H2PO4)2, …
- Muối hiđrophotphat: Na2HPO4, CaHPO4, …
1. Tính tan
Tất cả các muối đihiđrophotphat đều tan trong nước. Các muối hiđrophotphat và photphat trung hòa đều không tan hoặc ít tan trong nước (trừ muối natri, kali, amoni).
2. Nhận biết ion photphat ()
- Thuốc thử là bạc nitrat.
- Hiện tượng: Xuất hiện kết tủa màu vàng.
- Phương trình ion rút gọn:
3Ag+ + → Ag3PO4↓ (màu vàng)
Lưu ý: Kết tủa Ag3PO4 không tan trong nước, nhưng tan trong dung dịch axit nitric loãng.

Hình 2: Cho AgNO3 tác dụng với Na3PO4.
Trắc nghiệm Hóa 11 Bài 11: Axit photphoric và muối photphat
Câu 1:
A.Cho photpho tác dụng với dung dịch HNO3đặc, nóng.
B.Cho dung dịch H2SO4đặc, nóng tác dụng với quặng apatit.
C.Đốt cháy photpho trong oxi dư, cho sản phẩm tác dụng với nước.
D.Cho dung dịch axit H2SO4đặc, nóng tác dụng với quặng photphorit.
Đáp án: C
Giải thích:
Để thu được axit H3PO4 có độ tinh khiết và nồng độ cao hơn, người ta đốt cháy photpho để thu được P2O5, rồi cho P2O5 tác dụng với nước:
4P + 5O2 2P2O5.
P2O5+ 3H2O → 2H3PO4
Câu 2:
A.CaHPO4
B.Ca3(PO4)2
C.NH4H2PO4
D.Ca(H2PO4)2
Đáp án: B
Giải thích: Thành phần chính của quặng photphorit là Ca3(PO4)2.
Câu 3:
A.manhetit.
B.apatit.
C.cromit.
D.boxit.
Đáp án: B
Giải thích: Thành phần chính của quặng apatit là 3Ca3(PO4)2.CaF2.
Câu 4:
A.photpho
B.điphotpho pentaoxit.
C.photphin.
D.canxi photphat.
Đáp án: C
Giải thích:
Các cách điều chế H3PO4 là
P+5HNO3→H3PO4+5NO2+H2O
P2O5+ 3H2O→ 2H3PO4
Ca3(PO4)2+3H2SO4 đặc, nóng →3CaSO4↓+2H3PO4
Không điều chế được H3PO4 từ PH3 (photphin)
Câu 5:Hoà tan 28,4 gam điphotpho pentaoxit trong 500 gam dung dịch axit photphoric có nồng độ 9,8%. Nồng độ % của dung dịch axit photphoric thu được là
A.17,04%
B.17,64%
C.16,69%
D.18,02%
Đáp án: C
Giải thích:
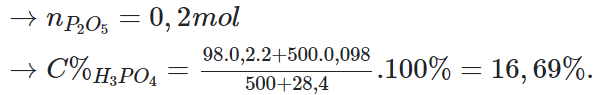
Câu 6:
A.11,36%
B.20,8%
C.24,5%
D.22,7%
Đáp án: B
Giải thích:
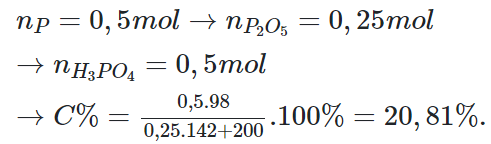
Câu 7:
A.NaH2PO4.
B.NaH2PO4và Na2HPO4.
C.Na2HPO4và Na3PO4.
D.Na3PO4.
Đáp án: B
Giải thích:
→ muối thu được sau phản ứng là NaH2PO4 và Na2HPO4
Câu 8:
A.1,426.
B.1,395.
C.1,302.
D.1,085.
Đáp án: C
Giải thích:
Gọi công thức chung của 2 bazơ mà MOH
Ta có:
TH1: Dung dịch sau phản ứng chỉ chứa muối
→
Bảo toàn khối lượng cho phản ứng H3PO4 + kiềm ta có :
mmuối +
→ mchất rắn + 0,15.18
→ m = 1,4389 gam
→ Không thỏa mãn.
TH2: Chất rắn có chứa MOH dư (a mol) và M3PO4 (b mol)
Ta có hệ phương trình:
Bảo toàn nguyên tố P:
Câu 9:Hòa tan 19,2gam Cu vào 500 ml dung dịch NaNO31M sau đó thêm vào 500 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch X và khí NO duy nhất. Phải thêm bao nhiêu ml dung dịch NaOH 1M vào X để kết tủa hết Cu2+?
A.600 ml.
B.800 ml.
C.400 ml.
D.120 ml.
Đáp án: B
Giải thích:
Số mol electron tối đa mà nhận là:
Số mol electron tối đa mà Cu nhường là:
→ Cu đã phản ứng hết và axit dư
Bảo toàn electron:
→
→ phản ứng =
→ dư = 0,2 mol
→ dư = 0,8 mol
lít = 800ml
Câu 10:
A.63%.
B.32%.
C.49%.
D.56%.
Đáp án: C
Giải thích:
Ta có:→ thêm = 2 mol.
mdung dịch A = 142 + 500 = 642 gam.