Anonymous
0
0
Giải Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
- asked 6 months agoVotes
0Answers
0Views
Mục lục Giải Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Video giải Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Bài 1 trang 159 Hóa 11: Ứng với công thức phân tử C8H10 có bao nhiêu đồng phân hiđrocacbon thơm?
Lời giải:
Đáp án C
4 đồng phân hiđrocacbon thơm của C8H10 là:
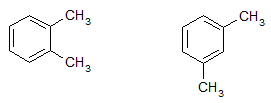
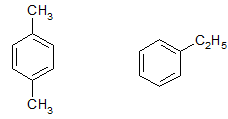
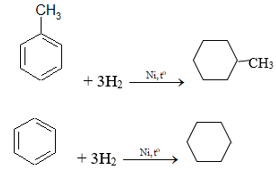
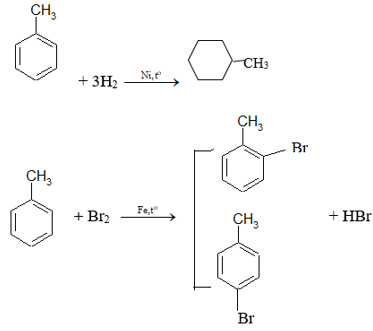
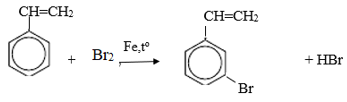
Bài 2 trang 159 Hóa 11: Toluen và benzen cùng phản ứng được với chất nào sau đây: (1) dung dịch brom trong CCl4; (2) dung dịch kali pemanganat; (3) hiđro có xúc tác Ni, đun nóng; (4) Br2 có bột Fe, đun nóng? Viết phương trình hoá học của các phương trình xảy ra.
Lời giải:
Toluen và benzen cùng phản ứng hiđro có xúc tác Ni, đun nóng; Br2 có bột Fe đun nóng.
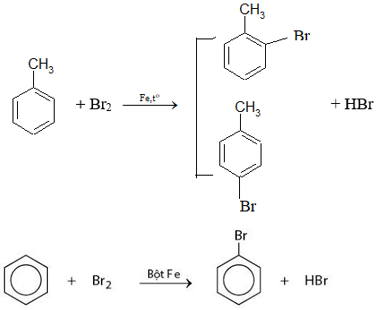
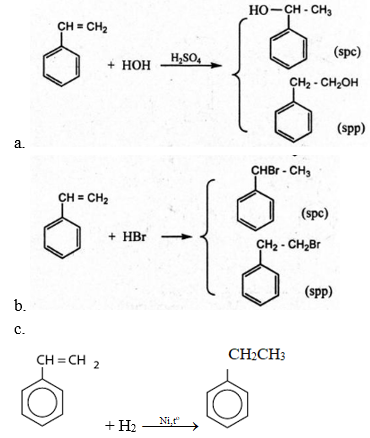
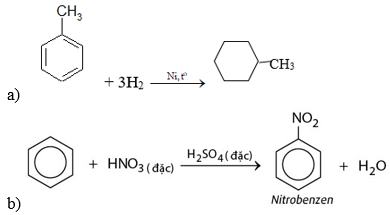
Bài 3 trang 159 Hóa 11: Viết phương trình hoá học của các phản ứng xảy ra trong mỗi trường hợp sau:
a. Toluen tác dụng với hiđro có xúc tác Ni, áp suất cao, đun nóng.
b. Đun nóng benzen với hỗn hợp HNO3 đặc và H2SO4 đặc.
Lời giải:
Bài 4 trang 160 Hóa 11: Trình bày phương pháp hoá học phân biệt các chất: benzen, hex-1-en và toluen. Viết phương trình hoá học của các phản ứng đã dùng
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng làm mẫu thử.
- Cho lần lượt từng mẫu thử tác dụng với dung dịch Br2, mẫu thử nào dung dịch Br2 nhạt dần đến mất màu thì đó là hex-1-en.
Phương trình hóa học:
CH2 = CH – [CH2]3 – CH3 + Br2 → CH2Br – CHBr – [CH2]3 – CH3
- Hai mẫu thử còn lại không làm mất màu dung dịch brom. Lần lượt cho từng mẫu thử qua dung dịch KMnO4, đun nóng. Mẫu thử nào làm mất màu dung dịch KMnO4 thì đó là toluen.
Phương trình hóa học:
C6H5 – CH3 + 2KMnO4 C6H5 – COOK + 2MnO2 + KOH + H2O
Bài 5 trang 160 Hóa 11: Hiđrocacbon X là chất lỏng có tỉ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn thu được CO2 có khối lượng bằng 4,28 lần khối lượng H2O. Ở nhiệt độ thường, X không làm mất màu dung dịch brom; khi đun nóng, X làm mất màu KMnO4.
a. Tìm công thức phân tử và viết công thức cấu tạo của X?
Lời giải:
a/ Gọi CTPT của X là CxHy:
Ta có: MX = 3,17. 29 = 92
⇒ 12x + y = 92 (1)
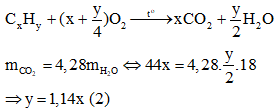
Từ (1) và (2) ⇒ x = 7, y = 8. CTPT của X là C7H8
Từ đề bài ⇒ CTCT của X là:
b/ Các phương trình hóa học:
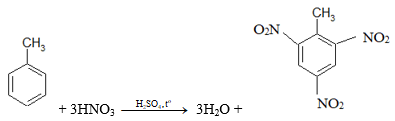
Bài 6 trang 160 Hóa 11: Đánh dấu (+) vào ô cặp chất phản ứng với nhau theo mẫu sau:
benzen |
hexen |
toluen |
etilen | |
Lời giải:
benzen |
hexen |
toluen |
etilen | |
|
H2, xúc tác Ni |
+ |
+ |
+ |
+ |
|
Br2 (dd) |
+ |
+ | ||
|
Br2 có Fe, đun nóng |
+ |
+ |
+ |
+ |
|
Dd KMnO4 đun nóng |
+ |
+ |
+ | |
|
HBr |
+ |
+ | ||
|
H2O (xt H+) |
+ |
+ |
Bài 7 trang 160 Hóa 11: Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzen. Tính khối lượng nitrobenzen thu được khi dùng 1,00 tấn benzen với hiệu suất 78,0%.
Lời giải:
Phương trình phản ứng:
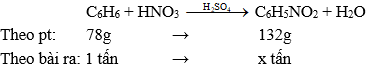
Do hiệu suất phản ứng đạt 78%, nên khối lượng nitrobenzen thu được là
tấn
Bài 8 trang 160 Hóa 11: So sánh tính chất hoá học của etylbenzen với stiren, viết phương trình hoá học của phản ứng để minh hoạ.
Lời giải:
a. Giống nhau: đều phản ứng thế H ở vòng benzen
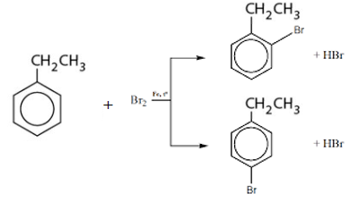
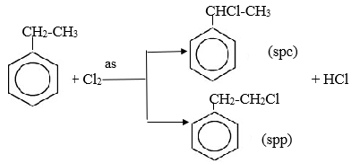
b. Khác nhau:
Etylbenzen có tính chất giống ankan
Stiren có tính chất giống anken:
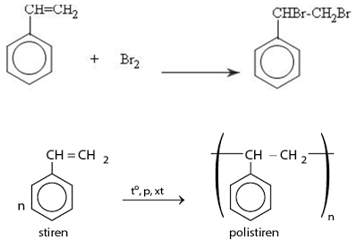
Bài 9 trang 160 Hóa 11: Dùng công thức cấu tạo viết phương trình hoá học của stiren với:
c. H2 (theo tỉ lệ mol 1:1, xúc tác Ni)
Lời giải:
Bài 10 trang 160 Hóa 11: Trình bày phương pháp hoá học phân biệt 3 chất lỏng sau: toluen, benzen, stiren. Viết phương trình hoá học của các phản ứng hoá học đã dùng.
Lời giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm tương ứng (làm mẫu thử).
- Cho lần lượt 3 mẫu thử tác dụng với dung dịch KMnO4 ở nhiệt độ thường, chất nào làm mất màu dung dịch KMnO4 ở nhiệt độ thường là stiren.
3C6H5 – CH = CH2 + 2KMnO4 + 4H2O → 3C6H5 – CHOH – CH2OH + 2MnO2 + 2KOH
- Với 2 hỗn hợp phản ứng còn lại ta đem đun nóng, chất nào làm mất màu dung dịch KMnO4 (nóng) thì là toluen, còn lại là benzen.
C6H5 – CH3 + 2KMnO4 C6H5 – COOK + 2MnO2 + KOH + H2O
Bài 11 trang 160 Hóa 11: Khi tách hiđro của 66,25 kg etylbenzen thu được 52,00 kg stiren. Tiến hành phản ứng trùng hợp toàn bộ lượng stiren này thu được hỗn hợp A gồm polistiren và phần stiren chưa tham gia phản ứng. Biết 5,20 gam A vừa đủ làm mất màu của 60,00 ml dung dịch brom 0,15M.
a. Tính hiệu suất của phản ứng tách hiđro của etylbenzen.
b. Tính khối lượng stiren đã trùng hợp.
c. Polistren có phân tử khối trung bình bằng 3,12.105. Tính hệ số trùng hợp trung bình của polime.
Lời giải:
a. Xét phản ứng tách H2 của etylbenzen
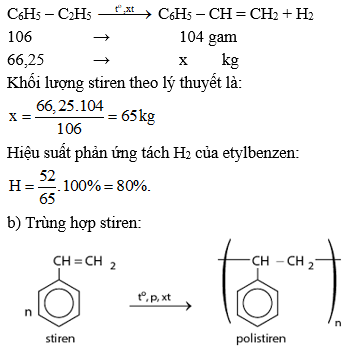
Stiren dư phản ứng với Br2:
C6H5 – CH = CH2 + Br2 → C6H5 – CHBr – CH2Br
Theo bài ra 5,2 gam A làm mất màu 0,06.0,15 = 0,009 mol Br2
Vậy 52kg A làm mất màu 90 mol Br2
Khối lượng stiren còn dư sau phản ứng trùng hợp:
mstiren dư = 90.104 = 9360 gam = 9,36 kg.
Khối lượng stiren đã trùng hợp là:
mstiren pư = mstiren bđ – mstiren dư
= 52 – 9,36 = 42,64 kg.
c. Hệ số trùng hợp trung bình của polime là:
Bài 12 trang 161 Hóa 11: Trình bày cách đơn giản để thu được naphtalen tinh khiết từ hỗn hợp naphtalen có lẫn tạp chất không tan trong nước và không bay hơi.
Lời giải:
Úp miệng phễu có gắn giấy đục lỗ trên bát đựng hỗn hợp naphtalen và tạp chất, đun nóng, như hình minh họa sau:
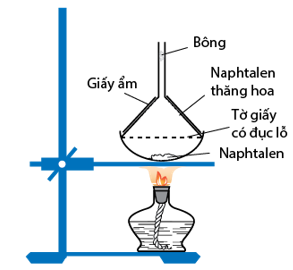
Naphtalen thăng hoa tạo các tinh thể hình kim bám trên mặt giấy, ta thu được naphtalen tinh khiết.
Bài 13 trang 161 Hóa 11: Từ etilen và benzen, tổng hợp được stiren theo sơ đồ:
C6H6 C6H5 – C2H5 C6H5 – CH = CH2
a. Viết các phương trình hoá học thực hiện sự biến đổi trên?
b. Tính khối lượng stiren thu được từ 1,00 tấn benzen nếu hiệu suất của quá trình là 78%.
Lời giải:
a/ C6H6 + C2H4 C6H5 – C2H5
C6H5 – C2H5 C6H5 – CH = CH2
b/ Ta có sơ đồ:
C6H6 → C6H5 – CH = CH2
78 gam → 104 gam
1 tấn → x tấn
Do hiệu suất cả quá trình là 78%, khối lượng stiren thu được là:
m = tấn.