Anonymous
0
0
Lý thuyết Benzen và đồng đẳng. Một số hiđrocacbon thơm khác (mới 2023 + Bài Tập) - Hóa học 11
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Bài giảng Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
A - Benzen và đồng đẳng
I - Đồng đẳng, đồng phân, danh pháp, cấu tạo
1. Dãy đồng đẳng của benzen
- Dãy đồng đẳng của benzen có công thức chung là CnH2n – 6 (n ≥ 6).
2. Đồng phân, danh pháp
- Cách đọc tên theo danh pháp hệ thống:
Tên = số chỉ vị trí nhánh + tên nhánh + benzen
Lưu ý:
+ Đánh số trên vòng sao cho tổng vị trí nhánh trên vòng là nhỏ nhất.
+ Nếu 2 nhóm thế trên vòng benzen ở vị trí: 1,2 – ortho; 1,3 – meta; 1,4 – para.
Thí dụ:
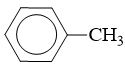 : có tên thông thường là toluen, tên thay thế là metylbenzen.
: có tên thông thường là toluen, tên thay thế là metylbenzen.
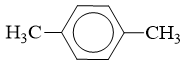 : có tên thông thường là p-xilen, tên thay thế là 1,4-đimetylbenzen (p-đimetylbenzen).
: có tên thông thường là p-xilen, tên thay thế là 1,4-đimetylbenzen (p-đimetylbenzen).
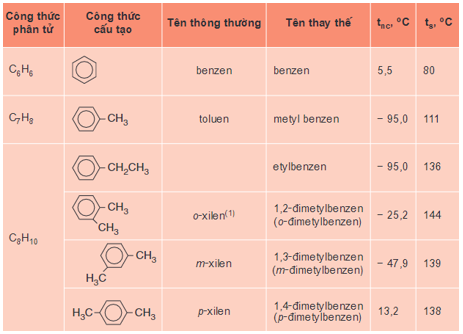
Bảng 1: Tên và hằng số vật lí của một số hiđrocacbon thơm đầu dãy đồng đẳng
- Từ C8H10 trở đi có các đổng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen và về cấu tạo mạch cacbon của mạch nhánh.
3. Cấu tạo
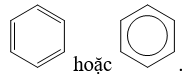
- Công thức cấu tạo của benzen (C6H6) là:
II. TÍNH CHẤT VẬT LÍ
- Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
- Các hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, có khả năng hoà tan nhiều chất hữu cơ.
III. TÍNH CHẤT HOÁ HỌC
Các đồng đẳng của benzen có tính chất của vòng benzen và có tính chất của mạch nhánh ankyl.
1. Phản ứng thế
a) Thế nguyên tử H của vòng benzen
* Phản ứng với halogen

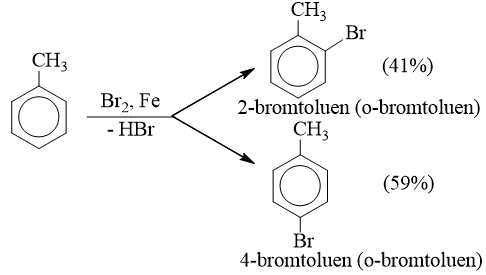
- Nếu cho các ankylbenzen phản ứng với brom trong điều kiện có bột sắt sẽ thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí para và ortho so với nhóm ankyl:
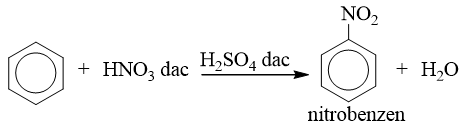
* Phản ứng với axit nitric
* Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
b) Thế nguyên tử H của mạch nhánh
- Nếu đun toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan.
Thí dụ:
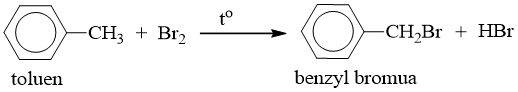
2. Phản ứng cộng
a) Cộng hiđro
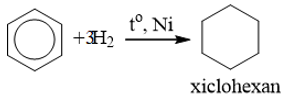
b) Cộng clo
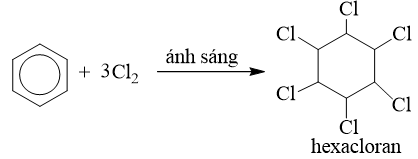
3. Phản ứng oxi hoá
a) Phản ứng oxi hoá không hoàn toàn
- Benzen và các ankylbenzen không làm mất màu dung dịch thuốc tím ở nhiệt độ thường.
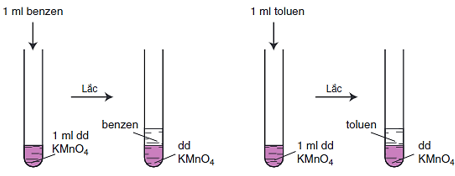
Hình 1: Benzen và toluen không làm mất màu dung dịch KMnO4 ở nhiệt độ thường
- Khi đun nóng, benzen không làm mất màu dung dịch thuốc tím nhưng ankylbenzen làm mất màu dung dịch thuốc tím
Thí dụ: Toluen làm mất màu dung dịch kali pemanganat.
Phương trình hóa học:
C6H5 – CH3 + 2KMnO4 C6H5 – COOK + 2MnO2↓ + KOH + H2O
b) Phản ứng oxi hoá hoàn toàn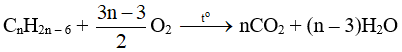
B - Một vài hiđrocacbon thơm khác
I. Stiren
1. Cấu tạo và tính chất vật lí
- Công thức phân tử: C8H8
- Công thức cấu tạo:
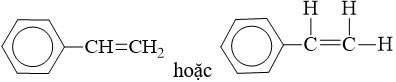
- Stiren (còn gọi là vinylbenzen) là chất lỏng không màu, sôi ở 146oC, tan nhiều trong dung môi hữu cơ.
2. Tính chất hoá học
a) Phản ứng với dung dịch brom
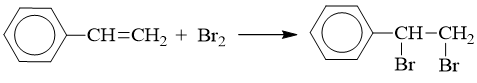
b) Phản ứng với hiđro
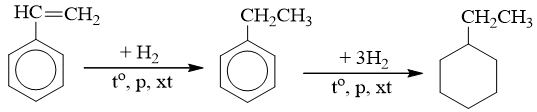
c) Phản ứng trùng hợp
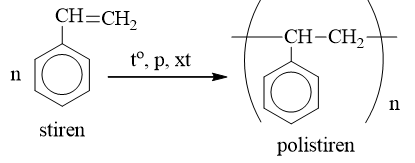
II. Naphtalen
1. Cấu tạo và tính chất vật lí
- Công thức phân tử: C10H8
- Phân tử naphtalen có cấu tạo phẳng:
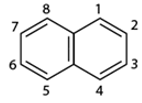
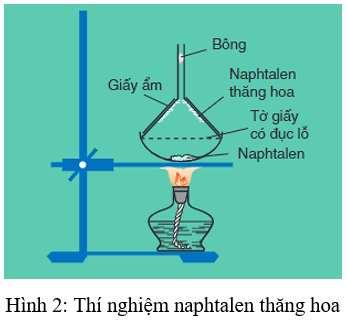
2. Tính chất hoá học
- Naphtalen không làm mất màu dung dịch KMnO4 ở điều kiện thường.
- Naphtalen có tính chất hóa học tương tự benzen.
a) Phản ứng thế
- Naphtalen tham gia phản ứng thế tương tự benzen, nhưng phản ứng xảy ra dễ dàng hơn và thường ưu tiên thế vào vị trí số 1.
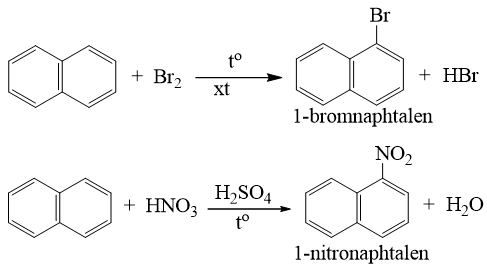
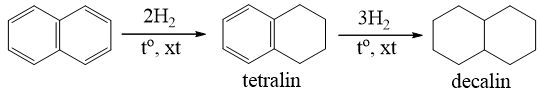
b) Phản ứng cộng
- Khi có chất xúc tác, naphtalen cộng hiđro tạo ra đecalin:
C - Ứng dụng của một số hiđrocacbon thơm
- Benzen và toluen là nguyên liệu rất quan trọng cho công nghiệp hoá học.
- Nguồn cung cấp benzen, toluen chủ yếu là từ nhựa than đá và từ sản phẩm đề hiđro đóng vòng hexan, heptan tương ứng.

Trắc nghiệm Hóa học lớp 11 Bài 35: Benzen và đồng đẳng. Một số hidrocacbon thơm khác
Câu 1:
A.Benzen
B.Hexametyl benzen
C.Toluen
D.o - Xilen
Đáp án: B
Giải thích:
X là hexametyl benzen:
- Khi có mặt Fe không thế vào nhân vì không còn H
- Thế Br2 phía ngoài vòng thu được sản phẩn duy nhất là:
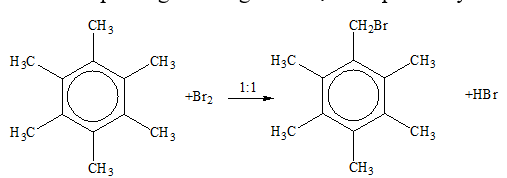
Câu 2:
A.Brom (dd).
B.Br2(Fe).
C.KMnO4(dd).
D.Br2(dd) hoặc KMnO4(dd).
Đáp án: C
Giải thích:
Thuốc thử phù hợp là KMnO4 (dd):
- Mất màu ngay ở nhiệt độ thường → stiren
- Mất màu khi đun nóng → toluen
- Không mất màu ở bất kì điều kiện nào → benzen
Câu 3:
A.4 mol H2; 1 mol brom.
B. 3 mol H2; 1 mol brom.
C.3 mol H2; 3 mol brom.
D.4 mol H2; 4 mol brom.
Đáp án: A
Giải thích:
C8H8 có k = = 5 tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức → có chứa 1 nối đôi ngoài vòng và 1 vòng benzen
→ Chỉ cộng tối đa 4 mol H2 (3π trong vòng + 1π ngoài vòng) và 1 mol Br2 trong dung dịch (chỉ cộng vào 1π ngoài vòng)
Câu4:
A.C6H6(1 đồng phân); C7H8(1 đồng phân).
B.C7H8(1 đồng phân); C8H10(4 đồng phân).
C.C6H6(1 đồng phân); C8H10(2 đồng phân).
D.C6H6(1 đồng phân); C8H10(4 đồng phân).
Đáp án: D
Giải thích:
Theo đề bài: MX = 3,067.30 = 92
Đặt công thức chung của X là
→ 1 chất là C6H6 và chất còn lại có số C > 7
→ Loại A và B
Loại C do C8H10 có 4 đồng phân:
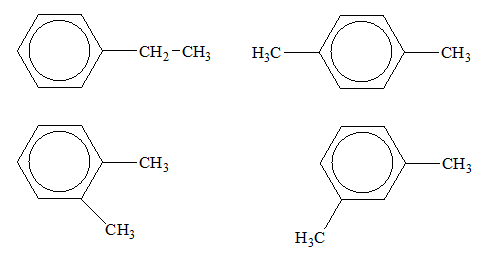
Câu 5:
A.67,6%.
B.73,49%.
C.85,3%.
D.65,35%
Đáp án: A
Giải thích:
Ta có:
m benzen = 100.0,879 = 87,9 gam
→ n benzen =
m brom benzen = 80.1,495 = 119,6 gam
→ n brom benzen =
Câu 6:
A.13,52 tấn.
B.10,6 tấn.
C.13,25 tấn.
D.8,48 tấn.
Đáp án: C
Giải thích:
Sơ đồ phản ứng:
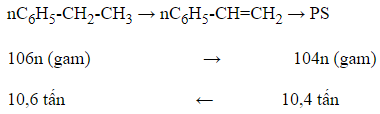
Do hiệu suất chỉ đạt 80% nên lượng etylbenzen thực tế cần dùng là:
= 13,25 tấn
Câu 7:
A.0,01
B.0,05
C.0,06
D.0,02
Đáp án: A
Giải thích:
Hoặc sử dụng công thức:
mol
Câu 8:
A.14 gam.
B.16 gam.
C.18 gam.
D.20 gam.
Đáp án: C
Giải thích:
C6H6+ Cl2 C6H5Cl + HCl
0,16 → 0,16= 0,16 . 112,5 = 18(g)
Câu 9:
A.1 mol C6H5Cl; 1 mol HCl; 1 mol C6H4Cl2.
B.1,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
C.1 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
D.0,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
Đáp án: D
Giải thích:
phản ứng tạo hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2
PTHH:
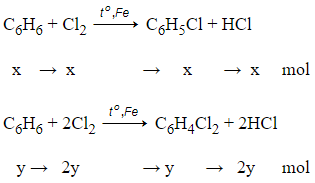
Theo đề bài ta có:
= x + y = 1 (1)
= x + 2y = 1,5 (2)
Giải (1) và (2) thu được x = y = 0,5 mol
Như vậy sau phản ứng thu được: 0,5 mol C6H5Cl; 0,5 mol C6H4Cl2 và 1,5 mol HCl
Câu 10:
A.o- hoặc p-đibrombenzen.
B.o- hoặc p-đibromuabenzen.
C.m-đibromuabenzen.
D.m-đibromben
Đáp án: A
Giải thích:
Đặt CTPT của hợp chất X là (C3H2Br)n
suy ra
(12.3+2+80).n = 236
→ n = 2.
Do đó công thức phân tử của X là C6H4Br2.
Vì hợp chất X là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe) nên theo quy tắc thế trên vòng benzen ta thấy X có thể là o-đibrombenzen hoặc p-đibrombenzen (vì Br là nhóm thế loại 1 nên nguyên tử Br còn lại sẽ vào vị trí o- hoặc p-).