Anonymous
0
0
Giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
- asked 6 months agoVotes
0Answers
0Views
Mục lục Giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Video giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Bài 1 trang 61 Hóa 11: Hãy cho biết số oxi hóa của N và P trong các phân tử và ion sau đây NH3, , , , NH4HCO3, P2O3, PBr5, , KH2PO4, Zn3(PO4)2.
Lời giải:
, , , , , ,
Bài 2 trang 61 Hóa 11: Trong các công thức sau đây, chọn công thức hóa học đúng của magie photphua:
Lời giải:
Đáp án C
Magie photphua là hợp chất của Mg và P.
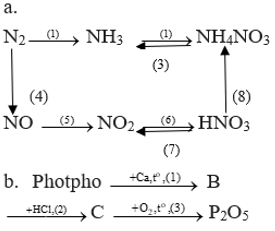
Bài 3 trang 61 Hóa 11: a) Lập các phương trình hóa học sau đây:
Ca(H2PO4)2 và Ca(OH)2 với tỉ lệ mol 1:1 (3)
Lời giải:
a)
2NH3 + 3Cl2 → N2 + 6HCl (1)
8NH3 + 3Cl2 → N2 + 6NH4Cl (2)
NH3 + CH3COOH → CH3COONH4 (3)
(NH4)3PO4 H3PO4 + 3NH3 (4)
Zn(NO3)2 2Zn + 4NO2 + O2 (5)
b)
(1) 2K3PO4 + 3Ba(NO3)2 → Ba3(PO4)2↓ + 6KNO3
3Ba2+ + 2PO43- → Ba3(PO4)2↓
(2) 2Na3PO4 + 3CaCl2 → Ca3(PO4)2↓ + 6NaCl
3Ca2+ + 2PO43- → Ca3(PO4)2↓
(3) Ca(H2PO4)2 + Ca(OH)2 → 2CaHPO4↓ + 2H2O
Phương trình phân tử trùng phương trình ion rút gọn.
(4) 2(NH4)3PO4 + 3Ba(OH)2 → Ba3(PO4)2↓ + 6NH3↑ + 6H2O
6NH4+ + 2PO43- + 3Ba2+ + 6OH- → Ba3(PO4)2↓ + 6NH3↑ + 6H2O
Bài 4 trang 61 Hóa 11: Từ hiđro, clo, nitơ và các hóa chất cần thiết, hãy viết các phương trình hóa học (có ghi rõ điều kiện phản ứng) điều chế phân đạm amoni clorua.
Lời giải:
N2 + 3H2 2NH3
H2 + Cl2 2HCl
NH3 + HCl → NH4Cl (amoni clorua)
Bài 5 trang 62 Hóa 11: Viết phương trình hóa học thực hiện các dãy chuyển hóa sau:
Lời giải:
a)
(1) N2 + 3H2 2NH3
(2) NH3 + HNO3 → NH4NO3
(3) NH4NO3 N2O + 2H2O
(4) N2 + O2 2NO
(5) 2NO + O2 → 2NO2
(6) 4NO2 + O2 + 2H2O → 4HNO3
(7) 4HNO4 4NO2 + O2 + 2H2O
(8) 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
b)
(1) 2P + 3Ca Ca3P2 (B)
(2) Ca3P2 + 6HCl → 3CaCl2 + 2PH3
(3) 2PH3 + 4O2 P2O5 + 3H2O
Bài 6 trang 62 Hóa 11: Hãy đưa ra những phản ứng đã học có sự tham gia của đơn chất photpho, trong đó số oxi hóa của photpho:
Lời giải:
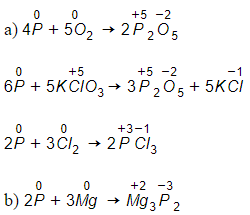
Bài 7 trang 62 Hóa 11: Khi cho 3,00 g hỗn hợp Cu và Al tác dụng với dung dịch HNO3 đặc dư, đun nóng, sinh ra 4,48 lít khí duy nhất NO2 (đktc). Xác định phần trăm khối lượng của mỗi kim loại trong hỗn hợp?
Lời giải:
Gọi nAl = x mol, nCu = y mol;
= 0,2 mol
mAl + mCu = m hỗn hợp
→ 27x + 64y = 3 (1)
Bảo toàn electron:
3.nAl + 2.nCu =
→ 3x + 2y = 0,2 (2)
Từ (1) và (2) suy ra:
x = 0,0492 mol;
y = 0,026 mol
→ %mAl = = 44,5%
%mCu = 100 – 44,5 = 55,5%
Bài 8 trang 62 Hóa 11: Cho 6,00 g P2O5 vào 25,0 ml dung dịch H3PO4 6,00% (D = 1,03 g/ml). Tính nồng độ phần trăm H3PO4 trong dung dịch tạo thành?
Lời giải:
= V. D = 25. 1,03
= 25,75g
ban đầu =
= 1,545 gam
P2O5 + 3H2O → 2H3PO4
Theo phương trình: = 2.
= 2. = mol
→ = .98
= 8,282 gam
(sau phản ứng) = 1,545 + 8,282
= 9,827(g)
Khối lượng dung dịch sau phản ứng
= 25,75 + 6 = 31,75(g)
C%H3PO4 =
= 30,95%
Bài 9 trang 62 Hóa 11: Cần bón bao nhiêu kg phân đạm amoni nitrat chứa 97,5% NH4NO3 cho 10,0 hecta khoai tây, biết rằng 1,00 hecta khoai tây cần 60,0 kg nitơ?
Lời giải:
10 ha khoai tây cần 60.10 = 600 kg nitơ
Bảo toàn nguyên tố Nitơ:
→ 1 mol (80g) NH4NO3 tạo thành 1 mol (28g) N2
Lượng NH4NO3 cần để có 600kg N2 là
= 1714,286 kg
Phân đạm amoni nitrat chứa 97,5% NH4NO3 nên lượng phân đạm cần bón là: