Anonymous
0
0
Một loại khí thiên nhiên có thành phần trăm về thể tích các khí như sau: 85,0% metan
- asked 6 months agoVotes
0Answers
1Views
Giải Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
Video Giải Bài 4 trang 169 Hóa học 11
Bài 4 trang 169 Hóa học 11:
a. Tính thể tích khí (đo ở đktc) cần để đun nóng 100,0 lít nước từ 20oC lên 100oC, biết nhiệt toả ra khi đốt 1 mol metan, 1 mol etan lần lượt bằng: 880kJ; 1560kJ và để nâng 1 ml nước lên 1o cần 4,18J.
b. Nếu chuyển được toàn bộ hiđrocacbon trong 1,000.103 m3 khí trên (đktc) thành axetilen, sau đó thành vinyl clorua với hiệu suất toàn bộ quá trình bằng 65,0% thì sẽ thu được bao nhiêu kilogam vinyl clorua?
Lời giải:
a. Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 - 20).(100.103)
= 33 440 000 (J)
= 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ;
nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là:
880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là:
1560.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên ở đktc cần dùng là:
36,991.22,4 = 828,6 (lít)
b. Ta có:
828,6 (lít) khí thiên nhiên có 0,85x (mol) CH4 và 0,1x (mol) C2H6
106 (lít) khí thiên nhiên có a (mol) CH4 và b (mol) C2H6
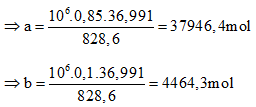
Ta có sơ đồ:
2CH4 → CH2 = CH – Cl
37946,4 → 18973,2 mol
C2H6 → CH2 = CH – Cl
4464,3 → 4464,3 mol
Số mol vinyl clorua thực tế là:
(18973,2 + 4464,3).0,65 = 15234,375 (mol)
Khối lượng vinyl clorua thực tế thu được là:
15234,375. 62,5 ≈ 952,15.103 (g) = 952,15 (kg)