Anonymous
0
0
Giải SBT Hóa 11 Bài 21: Công thức phân tử hợp chất hữu cơ
- asked 6 months agoVotes
0Answers
2Views
Mục lục Giải SBT Hóa 11 Bài 21: Công thức phân tử hợp chất hữu cơ
Bài 21.1 trang 29 sbt Hóa 11: Ở lớp 9, các em đã học về axetilen và benzen. Trong các nhận xét dưới đây về hai chất đó, nhận xét nào đúng?
A. Hai chất đó có cùng công thức phân tử và cùng công thức đơn giản nhất.
B. Hai chất đó khác nhau về công thức phân tử và khác nhau về công thức đơn giản nhất.
C. Hai chất đó khác nhau về công thức phân tử và giống nhau về công thức đơn giản nhất.
D. Hai chất đó giống nhau về công thức phân tử và khác nhau về công thức đơn giản nhất.
Lời giải:
Đáp án C
CTPT: axetilen: C2H2 → CTĐGN: CH
benzen: C6H6 → CTĐGN: CH
Bài 21.2 trang 29 sbt Hóa 11: Phát biểu nào dưới đây là đúng?
A. Hai hợp chất có cùng công thức đơn giản nhất thì bao giờ cũng có cùng công thức phân tử.
B. Hai hợp chất có công thức đơn giản nhất khác nhau vẫn có thể có cùng công thức phân tử.
C. Hai hợp chất có cùng công thức phân tử thì bao giờ cũng có cùng công thức đơn giản nhất.
Lời giải:
Đáp án C
Hai hợp chất có cùng công thức phân tử thì bao giờ cũng có cùng công thức đơn giản nhất.
Bài 21.3 trang 30 sbt Hóa 11: Đốt cháy hoàn toàn 2,20 g chất hữu cơ A, người ta thu được 4,40 g CO2 và 1,80 g H2O.
1. Xác định công thức đơn giản nhất của chất A.
Lời giải:
1. Đốt cháy hợp chất hữu cơ A thu được CO2 và H2O, vậy A chứa C, H và có thể có O.
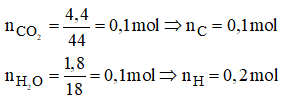
Ta có mO (A) = 2,2 – 0,1.12 – 0,2.1 = 0,8 gam
⇒ nO (A) = 0,8 : 16 = 0,05 mol
Đặt A có dạng: CxHyOz
Vậy x: y : z = 0,1 : 0,2 : 0,05 = 2 : 4 : 1
Do đó công thức đơn giản nhất của A là: C2H4O.
2. Số mol A trong 1,10 g A = số mol O2 trong 0,40 g O2
(mol)
(g/mol)
(C2H4O)n = 88 suy ra 44n = 88 suy ra n = 2
CTPT là C4H8O2.
Bài 21.4 trang 30 sbt Hóa 11: Để đốt cháy hoàn toàn 2,85 g chất hữu cơ X phải dùng vừa hết 4,20 lít O2 (đktc). Sản phẩm cháy chỉ có CO2 và H2O theo tỉ lệ 44 : 15 về khối lượng.
1. Xác định công thức đơn giản nhất của chất X.
2. Xác định công thức phân tử của X biết rằng tỉ khối hơi của X đối với C2H6 là 3,80.
Lời giải:
1.
= 2,85 + 32,0 = 8,85 (g)
Mặt khác = 44 : 15.
Từ đó tìm được: = 6,60g và = 2,25g.
Khối lượng C: (g)
Khối lượng H: (g)
Khối lượng O: 2,85 - 1,80 - 0,25 = 0,80 (g).
Chất X có dạng CxHyOz
x : y : z = 0,150 : 0,25 : 0,050 = 3 : 5 : 1
Công thức đơn giản nhất của X là C3H5O.
2. MX = 3,80.30,0 = 114,0 (g/mol)
(C3H5O)n = 114; 57n = 114 suy ra n = 2.
Công thức phân tử C6H10O2.
Bài 21.5 trang 30 sbt Hóa 11: Đốt cháy hoàn toàn 4,10 g chất hữu cơ A người ta thu được 2,65 g Na2CO3; 1,35 g H2O và 1,68 lít CO2 (đktc).
Xác định công thức đơn giản nhất của chất A.
Lời giải:
Chất A chắc chắn có C, H, Na, có thể có O.
Khối lượng C trong 1,68 lít CO2: (g)
Khối lượng C trong 2,65 g Na2CO3: g
Khối lượng C trong 4,10 g chất A: 0,9 + 0,3 = 1,20 (g).
Khối lượng Na trong 2,65 g Na2CO3: (g)
Khối lượng H trong 1,35 g H2O: (g)
Khối lượng O trong 4,10 g A: 4,10 - 1,20 - 0,15 - 1,15 = 1,60 (g)
Chất A có dạng CxHyOzNat
x : y : z : t = = 0,1 : 0,15 : 0,1 : 0,05
= 2 : 3 : 2 : 1.
Bài 21.6 trang 30 sbt Hóa 11: Để đốt cháy hoàn toàn 4,45 g hợp chất A cần dùng vừa hết 4,20 lít O2. Sản phẩm cháy gồm có 3,15 g H2O và 3,92 lít hỗn hợp khí gồm CO2 và N2. Các thể tích ở đktc. Xác định công thức đơn giản nhất của chất A.
Lời giải:
Theo định luật bảo toàn khối lượng:
= 7,3(g)
Đặt số mol CO2 là a, số mol N2 là b, ta có:
Suy ra a = 0,15 và b = 0,025
Khối lượng C: 0,150.12,0 = 1,80 (g).
Khối lượng H: (g)
Khối lượng N: 0,0250.28,0 = 0,700 (g).
Khối lượng O: 4,48 - 1,80 - 0,35 - 0,700 = 1,60 (g).
Chất A có dạng CxHyNzOt
x : y : z : t =
= 0,15 : 0,35 : 0,05 : 0,10 = 3 : 7 : 1 : 2
Công thức đơn giản nhất của A là C3H7NO2