Anonymous
0
0
TOP 40 câu Trắc nghiệm Hệ thống hóa về hidrocacbon thiên nhiên (có đáp án 2023) – Hóa 11
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa học lớp 11 Bài 38: Hệ thống hóa về hidrocacbon thiên nhiên
Bài 1:
A. CnH2n+2 (n ≥ 1).
B. CnH2n (n ≥ 2).
C. CnH2n-2 (n ≥ 2).
D. CnH2n-6 (n ≥ 6).
Đáp án: C
Giải thích:
Ankin là những hiđrocacbon không no, mạch hở, có công thức chung là CnH2n-2
(n ≥ 2).
Bài 2:
A. Trong hợp chất hữu cơ nguyên tử các nguyên tố liên kết với nhau đúng hóa trị theo một trật tự xác định
B. Hợp chất hữu cơ nhất thiết phải có chứa cacbon và hidro có thể chứa axit, nito, lưu huỳnh…
C. Các phản ứng hữu cơ thường xảy ra chậm và theo nhiều hướng khác nhau
D. Hai chất hơn kém nhau một hoặc nhiều nhóm CH2 chưa chắc đã là đồng đẳng của nhau
Đáp án: B
Giải thích: B sai vì hợp chất hữu cơ chỉ nhất thiết chứa C, có thể không có H.
Bài 3:
A. benzyl clorua
B. 2,4-đibromtoluen
C. p-bromtoluen và o-bromtoluen
D. m-bromtoluen
Đáp án: C
Giải thích: Toluen (C6H5CH3) có nhóm thế CH3-, khi phản ứng với Br2 (1:1) sẽ ưu tiên tạo thành o-bromtoluen và p-bromtoluen
Bài 4:
A. 4
B. 2
C. 3
D. 5
Đáp án: A
Giải thích:
Các sản phẩm có thể thu được là:
CH2 = C (CH3) - CHBr - CH2Br
CH2Br - C(CH3)Br - CH = CH2
CH2Br - C(CH3) = CH - CH2Br (cis - trans)
Bài 5:
A. 4
B. 5
C. 6
D. 3
Đáp án: A
Giải thích:
Các chất làm mất màu dung dịch KMnO4 là 4 chất: eten; axetilen; toluen; stiren
Lưu ý: Toluen làm mất màu dung dịch thuốc tím khi đun nóng.
Bài 6:
A. 3
B. 5
C. 2
D. 4
Đáp án: A
Giải thích:
Độ bất bão hòa k = (2.5 + 2 – 8) : 2 = 2
+ TH1: 1 liên kết ba
CH3 – CH(CH3) – C ≡ CH
+ TH2: 2 liên kết đôi
CH2 = C(CH3) – CH = CH3
CH3 – C(CH3) = C = CH2
→ Có 3 chất thỏa mãn đề bài
Bài 7:
A. 2-metylbut-2-en
B. but-2-en
C. 2-metylpropen
D. but-1-en
Đáp án: B
Giải thích:
But-2-en có cấu tạo đối xứng, khi cộng nước thu được 1 ancol duy nhất:
CH3-CH=CH-CH3 + H2O CH3-CH(OH)-CH2-CH3
Bài 8:
A. ankan và anken
B. 2 anken
C. ankan và ankin
D. ankan và ankadien
Đáp án: A
Giải thích:
Hỗn hợp gồm ankan và anken khi đốt cháy hoàn toàn sẽ thu được .
Hỗn hợp X không thể gồm ankan và anken
Bài 9:
A. 1:43
B. 1:40
C. đáp án khác
D. 1:35
Đáp án: A
Giải thích:
Đặt công thức của hỗn hợp có dạng là CnH2n+2
M hh = 2.38,8 → 14n + 2 = 77,6
→ n = 5,4
Giả sử nhh = 1 mol
BTNT O:
→ Vhh : Vkk = 1 : 43
Câu 10:
A. 35,8
B. 45,6
C. 38,2
D. 40,2
Đáp án: D
Giải thích:
Đốt cháy Y cũng là cháy X
BTNT “C”
Lại có:
→Hấp thụ sản phẩm cháy vào NaOH tạo 2 muối Na2CO3 và NaHCO3
Trong đó:
= 0,3 mol
→ = 0,4 – 0,3 = 0,1 mol
m chất tan trong Z= 0,3.106 + 0,1.84 = 40,2g
Bài 11:
A. 6
B. 4
C. 5
D. 3
Đáp án: D
Giải thích:
Có 3 đồng phân:
CH3-CH2-CH2-CH2-CH3;
CH3-CH(CH3)-CH2-CH3;
CH3-C(CH3)2-CH3
Bài 12:
A. C2H6
B. C3H6
C. C4H8
D. C3H8
Đáp án: C
Giải thích:
Giả sử V1 và V2 tương ứng với số mol n1 và n2 (n2 – n1 = 0,5)
→ n1.X + n2.Y = 107,5
Và n2.X + n1.Y = 91,25
Trừ 2 phương trình cho nhau :
(n1 – n2)X - (n1 – n2)Y = 16,25
→ 0,5.Y – 0,5.23,5 = 16,25
→ Y = 56 (C4H8)
Bài 13:
A. 2,352 lít.
B. 4,704 lít.
C. 7,056 lít.
D. 10,080 lít.
Đáp án: B
Giải thích:
CH3COONa + NaOH CH4 + Na2CO3
→ nY = nmuối axetat = 0,21 mol
→ V = 0,21.22,4 = 4,704 lít
Bài 14:
A. 0,25
B. 0,2
C. 0,15
D. 0,3
Đáp án: A
Giải thích:
BTKL: m hh đầu = mX
→ 0,35.26 + 0,65.2 = nX.8.2
→ nX = 0,65 mol
→ n giảm = = 0,35 + 0,65 – 0,65 = 0,35 mol
Mặt khác:
Bảo toàn mol liên kết π:
→ n π(Y) = 0,25 mol
→ nBr2 = n π(Y) = 0,25 mol
Bài 15:
A. 50%.
B. 25%.
C. 40%.
D. 75%
Đáp án: D
Giải thích:
Đốt cháy ankan:
Đốt cháy anken:
→ Đốt cháy hỗn hợp ankan, anken thì
nankan = = 0,05 mol
→ nanken = 0,2 – 0,05 = 0,15 mol
→ %nanken = 75%
Bài 16:
A. 1 : 2.
B. 2 : 3.
C. 2 : 1.
D. 1 : 3.
Đáp án: C
Giải thích:
Giả sử số mắt xích C4H6 là 1 và số mắt xích C8H8 là k. Ta có công thức cao su: C4H6(C8H8)k
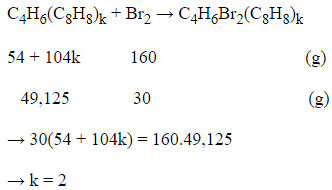
Tỉ lệ mắt xích stiren và butadien là 2 : 1
Bài 17:
A. 32,0 gam.
B. 3,2 gam.
C. 8,0 gam.
D. 16,0 gam.
Đáp án: C
Giải thích:
nX = 0,2 mol mà
BTKl → mY = mX = 2,9 gam
→ nY = 2,9 : 29 = 0,1 mol
→ phản ứng = nX – nY
= 0,2 – 0,1 = 0,1 mol
Bảo toàn liên kết π ta có:
= 0,15 – 0,1 = 0,05 mol
= 0,05.160 = 8 gam
Bài 18:
A. CH≡CH và CH3-C≡CH.
B. CH≡CH và CH3-CH2-C≡CH.
C. CH≡CH và CH3-C≡C-CH3.
D. CH3-C≡CH và CH3-CH2-C≡CH.
Đáp án: B
Giải thích:
BTNT “C”:
nC = = 0,6 mol
Bảo toàn khối lượng:
mX = mC + mH
→ mH = 8 – 0,6 .12 = 0,8
→ nH = 0,8 mol
BTNT “H”:
nankin =
= 0,6 – 0,4 = 0,2 mol
→ Số C trung bình = 0,6 : 0,2 = 3
Do 2 ankin ở đk thường tồn tại ở thể khí
→ có số C ≤ 4
→ Hỗn hợp X chứa 2 ankin là C2H2 (0,1 mol) và C4H6 (0,1 mol)
mAgC≡CAg = 24 g
Do lượng Kết tủa > 25 g
→ C4H6 cũng tạo kết tủa
→ CTCT của C4H6 là HC≡C-CH2-CH3
Bài 19:
A. Axetilen
B. Metan
C. Etilen
D. Benzen
Đáp án: C
Giải thích:
CH2 = CH2 (- CH2 – CH2 –)n
P.E
Chất trùng hợp tạo nhựa PE là C2H4 etilen
Bài 20:
A. 3,36 lít
B. 2,24 lít
C. 4,48 lít
D. 1,12 lít
Đáp án: B
Giải thích:
nkết tủa = 24:240=0,1 mol
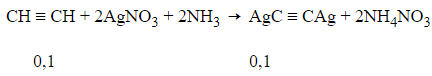
=> lít
Bài 21:
A. Có nối ba nằm đầu mạch
B. Có nhiều hơn 4 nguyên tử C
C. Có đồng phân hình học
D. Có nhiều hơn 4 nguyên tử H
Đáp án: A
Giải thích: Chỉ các ankin có nối ba nằm đầu mạch mới có phản ứng với dung dịch AgNO3/ NH3.
Bài 22: Cho 4,48 lít khí ankin có công thức phân tử C3H4 ở đktc vào dung dịch AgNO3/NH3 dư thu được a gam kết tủa. Giá trị của a là
A. 29 gam
B. 30 gam
C. 45gam
D. 29,4 gam
Đáp án: D
Giải thích:
C3H4 chỉ thế 1 nguyên tử Ag
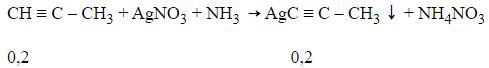
=> a= =0,2.147=29,4 gam
Bài 23: Cho 2,8 gam anken X vào bình dung dịch Br2 thấy có 16 gam Br2 phản ứng. Công thức phân tử của X là
A. C2H4
B. C3H6
C. C4H8
D. C5H10
Đáp án: A
Giải thích:
Bài 24:
A .50%;50%
B. 25%; 75%
C .45% ; 55%
D .20% ; 80%
Đáp án: A
Giải thích:
Áp dụng qui tắc đường chéo ta có :
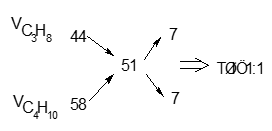
Vậy %C3H8 = %C4H10 = 50%
Bài 25:
A. 1,48g
B. 2,48 g
C. 14,8g
D. 24,7 g
Đáp án: A
Giải thích:
Bài 26:
A. 0,112 lít
B. 0,224 lít
C. 0,448 lít
D. 0,336 lít
Đáp án: C
Giải thích:
(lít)
Bài 27:
A. 3,36
B. 4,48
C. 6,72
D. 8,96
Đáp án: B
Giải thích:
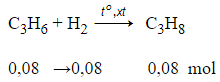
V = (0,04 + 0,08 + 0,08).22,4 = 4,48 lít
Bài 28:
A.C2H2 ;C3H4
B. C3H4 ; C4H6
C. C4H6 ; C5H8
D. C5H8 ; C2H2
Đáp án: A
Giải thích:
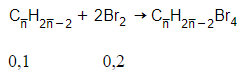
→ Mankin = 14 -2 = 3,3:0,1 = 33
→ = 2,5
Vậy 2 ankin là C2H2 ; C3H4
Bài 29:
A. 4,48 lít.
B. 5,6 lít.
C. 6,72 lít.
D. 8,96 lít.
Đáp án: C
Giải thích:
- Thể tích giảm chính là thể tích H2 phản ứng = 2,24 lít.
- Theo đề bài H2 hết nên thể tích hỗn hợp hiđrocacbon có trong X bằng thể tích hỗn hợp hiđrocacbon trước phản ứng = 6,72 lít.
Bài 30:
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,4 mol.
Đáp án: B
Giải thích:
nX = 0,3 + 0,1 = 0,4 mol
mX= 0,3.2 + 0,1. 52 = 5,8 gam
Theo định luật bảo toàn khối lượng: mY = mX = 5,8 g
Mặt khác MY = 29
Vậy số mol H2 phản ứng = 0,4 – 0,2 = 0,2 mol
Các câu hỏi trắc nghiệm Hóa học lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Dẫn xuất halogen của hidrocacbon có đáp án
Trắc nghiệm Luyện tập: Dẫn xuất halogen, ancol và phenol có đáp án