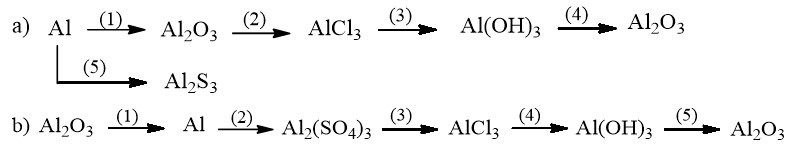Anonymous
0
0
Giải SBT Hóa 9 Bài 18: Nhôm
- asked 6 months agoVotes
0Answers
0Views
Mục lục Giải SBT Hóa 9 Bài 18: Nhôm
Bài 18.1 trang 22 SBT Hóa 9: Kim loại Al không phản ứng với dung dịch
Lời giải:
Đáp án B.
Kim loại Al thụ động trong dung dịch H2SO4 đặc, nguội và dung dịch HNO3 đặc, nguội.
→ Al không phản ứng với dung dịch H2SO4 đặc, nguội.
Bài 18.2 trang 22 SBT Hóa 9: Kim loại Al tác dụng được với dung dịch
Lời giải:
Đáp án D.
Nhôm sẽ phản ứng được với dung dịch muối của kim loại yếu hơn Al.
Phương trình hóa học:
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu↓
Bài 18.3 trang 22 SBT Hóa 9: Một kim loại có đủ các tính chất sau:
a) Nhẹ, dẫn điện và dẫn nhiệt tốt.
b) Phản ứng mạnh với dung dịch axit clohiđric.
c) Tan trong dung dịch kiềm giải phóng khí hiđro.
Lời giải:
Đáp án D.
Nhôm là kim loại có đủ các tính chất: nhẹ, dẫn điện, dẫn nhiệt, phản ứng mạnh với dung dịch axit clohiđric và tan trong dung dịch kiềm giải phóng khí hiđro.
Bài 18.4 trang 22 SBT Hóa 9: Nhằm xác định vị trí của những kim loại X, Y, Z, T trong dãy hoạt động hoá học, người ta thực hiện phản ứng của kim loại với dung dịch muối của kim loại khác, thu được những kết quả sau:
Thí nghiệm 1: Kim loại X đẩy kim loại Z ra khỏi muối.
Thí nghiệm 2: Kim loại Y đẩy kim loại Z ra khỏi muối.
Thí nghiệm 3: Kim loại X đẩy kim loại Y ra khỏi muối.
Thí nghiệm 4: Kim loại Z đẩy kim loại T ra khỏi muối.
Em hãy sắp xếp các kim loại theo chiều mức độ hoạt động hoá học giảm dần.
Lời giải:
Thí nghiệm 1 → X mạnh hơn Z
Thí nghiệm 2 → Y mạnh hơn Z
Thí nghiệm 3 → X mạnh hơn Y
Thí nghiệm 4 → Z mạnh hơn T
Mức độ hoạt động hoá học của các kim loại theo chiều giảm dần:
X > Y > Z > T
Bài 18.5 trang 23 SBT Hóa 9: Viết các phương trình hóa học thực hiện những chuyển đổi hóa học sau:
Lời giải:
a)
(1) 4Al + 3O2 2Al2O3
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
(4) 2Al(OH)3 Al2O3 + 3H2O
(5) 2Al + 3S Al2S3
b)
(1) 2Al2O3 4Al + 3O2↑
(2) 2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2↑
(3) Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4↓
(4) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
(5) 2Al(OH)3 Al2O3 + 3H2O
Bài 18.6* trang 23 SBT Hóa 9: Nhúng một lá nhôm vào dung dịch CuSO4. Sau một thời gian, lấy lá nhôm ra khỏi dung dịch thì thấy khối lượng dung dịch giảm 1,38 gam. Khối lượng của Al đã tham gia phản ứng là
Lời giải:
Đáp án C.
Gọi khối lượng miếng Al là a gam, lượng nhôm đã phản ứng là x gam :
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu↓
Gọi x gam là khối lượng Al phản ứng.
Theo phương trình, ta thấy:
Cứ 2.27 = 54 gam Al phản ứng với CuSO4 thì sinh ra 3.64 = 192 gam Cu.
Vậy x gam Al → gam Cu
Khối lượng dung dịch giảm 1,38 gam nên ta có phương trình:
mCu – mAl phản ứng = 1,38
→
Vậy khối lượng Al tham gia phản ứng là 0,54 gam.
Bài 18.7 trang 23 SBT Hóa 9: Hoà tan 4,5 gam hợp kim nhôm - magie trong dung dịch H2SO4 loãng, dư, thấy có 5,04 lít khí hiđro bay ra (đktc).
b) Tính thành phần phần trăm khối lượng của các kim loại trong hợp kim.
Lời giải:
Ta có:
a) Phương trình hóa học:
Mg + H2SO4 → MgSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
b) Gọi nMg = x mol; nAl = y mol
Theo phương trình ta có:
Ta có, hệ phương trình:
→ mMg = 0,075 . 24 = 1,8 gam; mAl = 0,1 . 27 = 2,7 gam
Phần trăm khối lượng của của các kim loại trong hợp kim là:
% mMg = = 40%;
% mAl = 100% - 40% = 60%
Bài 18.8 trang 23 SBT Hóa 9: Trong một loại quặng boxit có 50% nhôm oxit. Nhôm luyện từ oxit đó còn chứa 1,5% tạp chất. Tính lượng nhôm thu được khi luyện 0,5 tấn quặng boxit trên. Hiệu suất phản ứng 100%.
Lời giải:
Lượng nhôm oxit có trong 0,5 tấn quặng là:
= 0,25 tấn = 250kg
Phương trình hoá học điều chế Al:
2Al2O3 4Al + 3O2
Theo phương trình, ta thấy:
Cứ 2.102 = 204 gam Al2O3 điều chế được 4.27 = 108 gam Al
Vậy 250 kg Al2O3 điều chế được
Khối lượng Al lẫn tạp chất:
m = 132,353 . 101,5% = 134,338 (kg).
Bài 18.9 trang 23 SBT Hóa 9: Cho 5,4 gam Al vào 100 ml dung dịch H2SO4 0,5M.
a) Tính thể tích khí H2 sinh ra (đktc).
Lời giải:
a) nAl = = 0,2 mol;
= 0,1. 0,5 = 0,05 mol
Phương trình hóa học
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Ta có:
→ Al dư và tính lượng các chất theo lượng H2SO4.
Theo phương trình:
;
lít