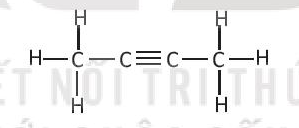Anonymous
0
0
Sách bài tập Hóa học 10 Bài 14 (Kết nối tri thức): Ôn tập chương 3
- asked 6 months agoVotes
0Answers
0Views
Giải sách bài tập Hóa học 10 Bài 14. Ôn tập chương 3
Nhận biết
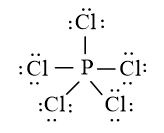
Bài 14.1 trang 36 SBT Hóa học 10
Lời giải
Đáp án đúng là: B
Quy tắc octet không đúng với trường hợp phân tử PCl5 vì xung quanh P có 10 electron liên kết.
Bài14.2 trang 36 SBT Hóa học 10
A. Giữa nguyên tử H và Cl có một liên kết đơn.
B. Các electron tham gia liên kết đồng thời bị hút về phía hai hạt nhân.
C. Phân tử có một momen lưỡng cực.
Lời giải
Đáp án đúng là: D
Phát biểu D là sai vì một electron của nguyên tử hydrogen và một electron của nguyên tử chlorine được góp chung và bị lệch về phía nguyên tử chlorine vì nguyên tử chlorine có độ âm điện lớn hơn.
Bài14.3 trang 36 SBT Hóa học 10
A. Tính bão hòa lớp electron ở vỏ nguyên tử.
C. Tạo ra hợp chất bền vững hơn.
Lời giải
Đáp án đúng là: D
Liên kết ion khác với liên kết cộng hóa trị là liên kết cộng hóa trị có tính định hướng trong không gian.
Liên kết cộng hóa trị được tạo thành do sự xen phủ các orbital theo trục liên kết (s, px, py, pz).
Bài14.4 trang 36 SBT Hóa học 10
Số liên kết σ trong phân tử A là
Lời giải
Đáp án đúng là: C
Cách 1:
Hợp chất A gồm 8 liên kết đơn là liên kết σ.
Liên kết ba C≡C gồm 1 liên kết σ và 2 liên kết π.
Vậy tổng số liên kết σ trong hợp chất A là 9.
Cách 2:
Công thức phân tử của hợp chất: C4H6
Số liên kết σ = số C + số H – 1 = 4 + 6 – 1 = 9.
Bài14.5 trang 36 SBT Hóa học 10
Phân tử nào sau đây có liên kết ion?
Lời giải
Đáp án đúng là: D
∆χ(Na3P) = |0,93 – 2,19| = 1,26
∆χ(MgS) = |1,31 – 2,58| =1,27
∆χ(AlCl3) = |1,61 – 3,16| = 1,55
∆χ(LiBr) = |0,98 – 2,96| = 1,98 > 1,7 ⇒ Liên kết ion.
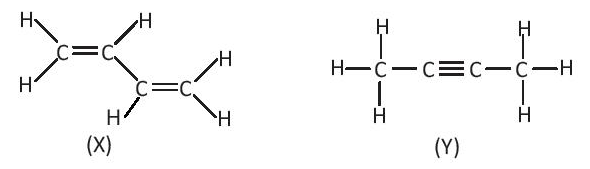
Bài14.6 trang 36 SBT Hóa học 10:
A. X và Y có số liên kết σ và số liên kết π bằng nhau.
B. X có số liên kết σ và số liên kết π nhiều hơn Y.
C. X có số liên kết σ nhiều hơn, nhưng số liên kêt π ít hơn Y.
D. X có số liên kết σ ít hơn, nhưng số liên kết π nhiều hơn Y.
Lời giải
Đáp án đúng là: A
X có 9 liên kết σ và 2 liên kết π.
Y có 9 liên kết σ và 2 liên kết π.
⇒ X và Y có số liên kết σ và số liên kết π bằng nhau.
Bài14.7 trang 37 SBT Hóa học 10:
C. Cộng hóa trị không phân cực
Lời giải
Đáp án đúng là: A
X là kim loại điển hình, Y là phi kim điển hình ⇒ Liên kết giữa X và Y là liên kết ion.
Thông hiểu
Bài14.8 trang 37 SBT Hóa học 10:
Lời giải
Đáp án đúng là: C
X có cấu hình electron là: 1s22s22p4⇒ X thuộc nhóm VIA, chu kì 2, là phi kim.
Y có cấu hình electron là: 1s22s22p63s23p64s1⇒ Y thuộc nhóm IA, chu kì 4, là kim loaị điển hình.
Z có cấu hình electron là: 1s22s22p63s23p4⇒ Z thuộc nhóm VIA, chu kì 3, là phi kim.
⇒Các cặp nguyên tố có thể tạo thành liên kết ion là (X, Y); (Y, Z)
Cặp nguyên tố có thể tạo thành liên kết cộng hóa trị phân cực là (X, Z).
Bài14.9 trang 37 SBT Hóa học 10:
Số chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là
Lời giải
Đáp án đúng là: A
Chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là: N2, H2 (hiệu độ âm điện bằng 0).
Bài14.10 trang 37 SBT Hóa học 10:
(1) H2S;(2) SO2;(3) NaCl;(4) CaO;
(5) NH3; (6) HBr;(7) CO2;(8) K2S;
Dãy nào sau đây gồm các chất có liên kết cộng hóa trị?
Lời giải
Đáp án đúng là: B
Các chất có liên kết cộng hóa trị là:
(1) H2S;(2) SO2;
(5) NH3; (6) HBr;(7) CO2;
Các chất còn lại có liên kết ion.
Bài14.11 trang 37 SBT Hóa học 10:
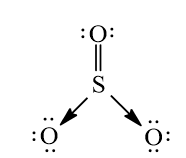
Lời giải
Nguyên tử trung tâm S có 6 electron lớp ngoài cùng và nguyên tử O cũng có 6 electron lớp ngoài cùng. Khi tạo thành phân tử SO3, nguyên tử S và 1 nguyên tử O dùng chung 2 cặp electron để tạo 2 liên kết cộng hóa trị kép phân cực. Để thỏa mãn quy tắc octet, liên kết cộng hóa trị giữa nguyên tử S và 2 nguyên tử O còn lại được thực hiện bằng sự cho – nhận 2 cặp electron của nguyên tử S. Kết quả, trong phân tử SO3, các nguyên tử S và O đều có 8 electron lớp ngoài cùng thỏa mãn quy tắc octet.
Công thức Lewis:
Bài14.12 trang 37 SBT Hóa học 10
Lời giải
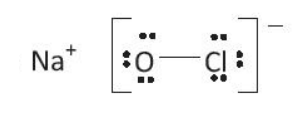
Sự hình thành các liên kết trong phân tử NaClO:
Nguyên tử Na có 1 electron lớp ngoài cùng, nguyên tử O có 6 electron lớp ngoài cùng và nguyên tử Cl có 7 electron lớp ngoài cùng.
Nguyên tử Na nhường đi 1 electron để trở thành ion Na+, có cấu hình electron bền vững của khí hiếm Ne. Nhóm nguyên tử OCl nhận thêm 1 electron để trở thành ion OCl-. Các ion này mang điện trái dấu sẽ hút nhau tạo thành liên kết ion.
Ion OCl- có 14 electron hóa trị:
6 (đối với O) + 7 (đối với Cl) + 1 (đối với điện tích âm) = 14 hay 7 cặp electron hóa trị. Sau khi tạo thành liên kết O-Cl và phân bố 6 electron còn lại chưa liên kết vào các nguyên tử, cả hai nguyên tử đều có 8 electron lớp ngoài cùng.
Công thức Lewis:
Vận dụng
Bài14.13 trang 38 SBT Hóa học 10
Lời giải
a) C2H4 có 5 liên kết σ và 1 liên kết π.
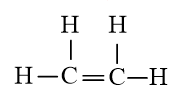
b) C2H2 có 3 liên kết σ và 2 liên kết π.
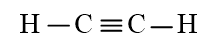
c) HCN có 2 liên kết σ và 2 liên kết π.
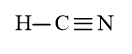
d) HCOOH có 4 liên kết σ và 1 liên kết π.
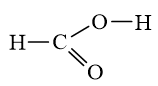
Bài14.14 trang 38 SBT Hóa học 10:
Lời giải
Bản chất các liên kết phụ thuộc vào hiệu độ âm điện giữa hai nguyên tử của hai nguyên tố tạo liên kết. Viết công thức cấu tạo các phân tử và tính hiệu độ âm điện để suy ra bản chất liên kết.
H-Cl=O có hiệu độ âm điện H-Cl là 0,96 ⇒Liên kết cộng hóa trị phân cực;
Cl-O là 0,28 ⇒Liên kết cộng hóa trị không phân cực.
K+ và [S-H]-có hiệu độ âm điện K và S là 1,76 ⇒ liên kết ion;
S-H là 0,38 ⇒ liên kết cộng hóa trị phân cực.
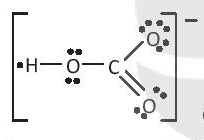 có hiệu độ âm điện H và O là 1,24 ⇒ liên kết cộng hóa trị phân cực;
có hiệu độ âm điện H và O là 1,24 ⇒ liên kết cộng hóa trị phân cực;
C-O có hiệu độ âm điện là 0,89 ⇒ liên kết cộng hóa trị phân cực.
* K+ và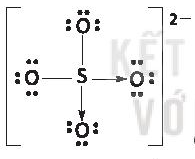 có hiệu độ âm điện K-O là 2,62 ⇒ liên kết ion;
có hiệu độ âm điện K-O là 2,62 ⇒ liên kết ion;
S-O là 1,54 ⇒ liên kết cộng hóa trị phân cực.
Bài14.15 trang 38 SBT Hóa học 10:
HF (19,5); HCl (-85); HBr (-66); HI (-35).
a) Nêu xu hướng biến đổi nhiệt độ sôi trong dãy chất trên.
b) Đề xuất lí do nhiệt độ sôi của HF không theo xu hướng này.
Lời giải
a) Nhiệt độ sôi của HF cao hơn hẳn so với HCl, HBr, HI.
Sự tăng nhiệt độ sôi từ HCl đến HI do khối lượng phân tử tăng.
b) HF có liên kết hydrogen làm cho các phân tử liên kết với nhau chặt chẽ hơn nên nhiệt độ sôi cao hơn hẳn so với HCl, HBr, HI.
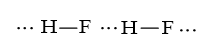
Bài14.16 trang 38 SBT Hóa học 10:
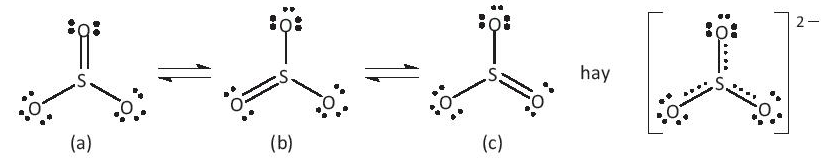
b) Đề xuất cấu tạo Lewis cho anion AB32- sao cho phù hợp với quy tắc octet.
Lời giải
a) Coi x và y là số proton (số electron) ở nguyên tử A và B tương ứng.
Ta có: x + 3y = 42 -2 = 40 ⇒ y < = 13,33.
B thuộc chu kì 2 và là một phi kim (tạo anion) nên B chỉ có thể là F, O hoặc N.
- Nếu B là F thì y = 9, trong có A với số oxi hóa bằng +1
⇒ x = 40 – (3.9) = 13 ~ Al (không hợp lí vì Al không có số oxi hóa bằng +1)
- Khi B là O thì = = 8, trong có A với số oxi hóa bằng +4
⇒ x = 40 – (3.8) = 16 ~ S (lưu huỳnh) ⇒ Anion là
- Khi B là N thì y = 7, trong có A với số oxi hóa bằng +7
⇒ x = 40 – (3.7) = 19 ~ K (không hợp lí vì K không có số oxi hóa bằng +7).
b) Cấu tạo Lewis:
Bài14.17 trang 38 SBT Hóa học 10
a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
Lời giải
a) Nguyên tố s có 7 electron s là K (1s22s22p63s23p64s1);
Nguyên tố p có 11 electron p là Cl (1s22s22p63s23p5);
Nguyên tố p có 4 electron p là O (1s22s22p4);
Khối lượng O trong X là: 122,5.0,3919 ≈ 48 (amu) ứng với 3 nguyên tử O.
Công thức X có dạng KxClyO3.
Theo bài ra ta có: 39x + 35,5y = 122,5 – 48 = 74,5
⇒ x = y = 1 ⇒ Công thức X: KClO3.
b) Cấu tạo X:
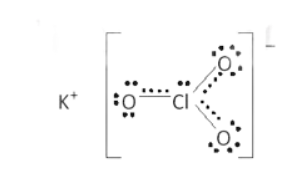
Gồm liên kết K+ và ClO3- là liên kết ion; liên kết đơn Cl-O và liên kết kép Cl=O là các liên kết công hóa trị phân cực