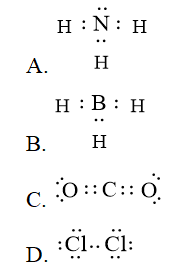Anonymous
0
0
Sách bài tập Hóa học 10 Bài 10 (Kết nối tri thức): Quy tắc octet
- asked 6 months agoVotes
0Answers
0Views
Giải sách bài tập Hóa học 10 Bài 10. Quy tắc octet
Nhận biết
Bài 10.1 trang 28 SBT Hóa học 10:
A. sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp giữa các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Lời giải:
Đáp án đúng là: B
Liên kết hóa học làsự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Lời giải:
Đáp án đúng là: D
Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống nhưnguyên tử khí hiếm gần kề (với 8 electron lớp ngoài cùng, riêng He có 2 electron lớp ngoài cùng).
Bài 10.3 trang 28 SBT Hóa học 10:
Lời giải:
Đáp án đúng là: A
Cấu hình electron các nguyên tử:
Z = 12: 1s22s22p63s2
Z = 9: 1s22s22p5
Z = 11: 1s22s22p63s1
Z = 10: 1s22s22p6
Nguyên tử có Z = 12 có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet.
Bài 10.4 trang 28 SBT Hóa học 10:
Lời giải:
Đáp án đúng là: B
Công thức
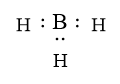
không đủ electron theo quy tắc octet vì B chưa đủ 8 electron lớp ngoài cùng.
Sửa lại:
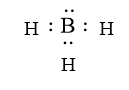
Thông hiểu
Bài 10.5 trang 28 SBT Hóa học 10:
Lời giải:
Đáp án đúng là: C
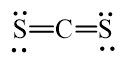
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là 4 cặp electron.
Bài 10.6 trang 28 SBT Hóa học 10:
Lời giải:
Đáp án đúng là: D
Trong phân tử BeH2 nguyên tử Be chưa đạt octet.
Phân tử AlCl3 nguyên tử Al chưa đạt octet.
Trong phân tử PCl5, lớp ngoài cùng của P có 10 electron, không tuân theo quy tắc octet
Bài 10.7 trang 28 SBT Hóa học 10:
Lời giải:
Đáp án đúng là: B
Quy tắc octet không đúng với trường hợpNO2
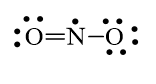
Nguyên tử N chỉ có 7 electron lớp ngoài cùng.
Bài 10.8 trang 29 SBT Hóa học 10:
Lời giải:
- Nguyên tử khí hiếm đều có cấu hình electron bão hòa là ns2np6 (trừ helium có cấu hình 1s2) làm cho nguyên tử khí hiếm rất bền vững nên các nguyên tử khí hiếm khó tham gia phản ứng hóa học. Trong tự nhiên, các khí hiếm đều tồn tại ở trạng thái nguyên tử (hay còn gọi là phân tử một nguyên tử) tự do, bền vững (nên còn gọi là các khí trơ).
- Nguyên tử của các nguyên tố khác có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững của khí hiếm, ví dụ: H2, Cl2, HCl, CO2, … hay tự tập hợp lại thành các khối tinh thể, ví dụ: tinh thể NaCl, …
Bài 10.9 trang 29 SBT Hóa học 10:
Lời giải:
- Nguyên tử potassium chỉ có 1 electron ở lớp ngoài cùng nên dễ dàng nhường đi electron này để tạo thành ion dương. Ion dương (K+) có cấu hình electron lớp ngoài cùng giống với khí hiếm argon (3s23p6) đứng trước potassium trong bảng tuần hoàn.
- Nguyên tử bromine có 7 electron ở lớp electron ngoài cùng nên dễ dàng nhận thêm 1 electron tạo ra anion bromide (Br-) có cấu hình electron lớp ngoài cùng giống với khí hiếm krypton (4s24p6), đứng sau bromine trong bảng tuần hoàn.
Bài 10.10 trang 29 SBT Hóa học 10:
Lời giải:
- Khi hình thành liên kết H + Cl → H-Cl thì hệ tỏa năng lượng và ngược lại khi phá vỡ liên kết H-Cl → H + Cl thì hệ thu thêm năng lượng.
- Xét về năng lượng thì phân tử H-Cl có năng lượng nhỏ hơn hệ hai nguyên tử H và Cl riêng rẽ. Trong hai hệ đó thì hệ H-Cl bền hơn hệ H và Cl.
Bài 10.11 trang 29 SBT Hóa học 10:
Lời giải:
Cấu hình electron của nguyên tử Na (Z = 11):
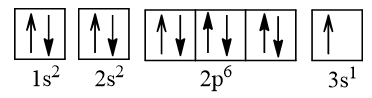
Cấu hình electron của nguyên tử S:
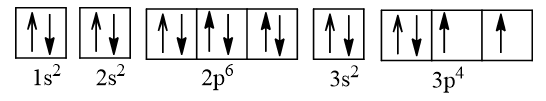
Khi Na kết hợp với S, mỗi nguyên tử Na nhường đi 1 electron hóa trị duy nhất để tạo thành cation Na+ có 8 electron ở vỏ nguyên tử giống với khí hiếm neon. Nguyên tử S có 6 electron hóa trị nhận thêm 2 electron từ hai nguyên tử Na tạo thành ion sulfide S2- có 8 electron ở vỏ nguyên tử giống với khí hiếm argon.
Hai nguyên tử Na và S đều đạt cấu hình electron bão hòa theo quy tắc octet trong phân tử sodium sulfide Na2S.
Vận dụng
Bài 10.12 trang 29 SBT Hóa học 10:
Lời giải:
- Nguyên tử O có 6 electron lớp ngoài cùng. Để tạo thành phân tử O2, mỗi nguyên tử O góp chung 2 electron tạo thành cặp electron dùng chung. Khi đó mỗi nguyên tử O đều có 8 electron lớp ngoài cùng, thỏa mãn quy tắc octet.

- Nguyên tử C có 4 electron lớp ngoài cùng, nguyên tử O có 6 electron lớp ngoài cùng. Để tạo thành phân tử CO2, nguyên tử C góp chung với mỗi O 2 electron. Khi đó C và O đều thỏa mãn quy tắc octet.

- Nguyên tử K có 1 electron lớp ngoài cùng, nguyên tử Br có 7 electron lớp ngoài cùng. Để tạo thành phân tử KBr, nguyên tử K nhường 1 electron tạo ion K+, nguyên tử Br nhận 1 electron từ nguyên tử K tạo ion Br-. Hai ion trái dấu hút nhau để tạo thành phân tử KBr.
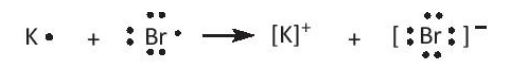
- Nguyên tử Ca có 2 electron lớp ngoài cùng, nguyên tử Cl có 7 electron lớp ngoài cùng. Để tạo thành phân tử CaCl2, nguyên tử Ca nhường 2 electron để tạo thành ion Ca2+, mỗi nguyên tử Cl nhận 1 electron từ nguyên tử Ca để tạo thành ion Cl-. Các ion trái dấu hút nhau tạo thành phân tử CaCl2

Bài 10.13 trang 29 SBT Hóa học 10:
Dựa vào quy tắc octet, đề xuất công thức cấu tạo của các chất trên.
Lời giải:
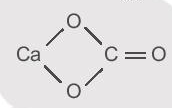
Công thức cấu tạo CaCO3:
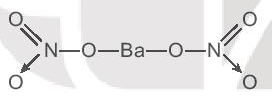
Công thức cấu tạo Ba(NO3)2:
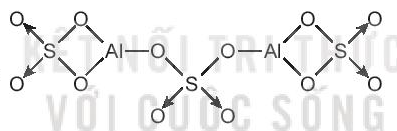
Công thức cấu tạo Al2(SO4)3:
Bài 10.14 trang 29 SBT Hóa học 10:
a) Hãy thiết lập công thức phân tử của X. Biết rằng A có số oxi hóa cao nhất trong X.
Lời giải:
a) A thuộc nhóm IVA và D thuộc nhóm VIA ⇒ số oxi hóa cao nhất của A trong X là +4 còn số oxi hóa của D trong X là -2.
Công thức phân tử X có dạng AD2. Ta có: A + 2D = 76.
⇒ Nguyên tử khối trung bình của A, D là: = 25,33
⇒ A và D thuộc chu kì 2, 3 ⇒ Có các cặp nguyên tố sau:
C = 12 và O = 16; C = 12 và S = 32; Si = 28 và O = 16; Si = 28 và S = 32.
C = 12 và S = 32 thỏa mãn A + 2D = 76 ⇒ Công thức X: CS2.
b) Đề xuất công thức Lewis:
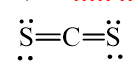
Công thức cấu tạo:
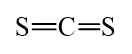
CS2 có cấu trúc thẳng giống CO2.
Các nguyên tử C và S đều có 8 electron lớp ngoài cùng theo quy tắc octet.