Anonymous
0
0
TOP 40 câu Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án 2023) – Hóa 11
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài giảng Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu 1:
A. Na+, , Mg2+,
B. K+, H+, ,
C. , Mg+, Ca2+,
D. , Na+, Ba2+,
Đáp án: A
Giải thích:
Câu 2:
A. H+ + OH– → H2O
B. Ba2+ + 2OH– + 2H+ + 2Cl– → BaCl2 + 2H2O
C. Ba2+ + 2Cl– → BaCl2
D. Cl– + H+ → HCl
Đáp án: A
Giải thích:
Phương trình phân tử:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Phương trình ion đầy đủ:
Ba2+ + 2OH– + 2H+ + 2 → Ba2+ + 2 + 2H2O
Phương trình ion rút gọn:
H+ + OH– → H2O
Câu 3:
Phương trình ion thu gọn của phản ứng trên là
A. HCl + OH – → H2O + .
B. 2H+ + Mg(OH)2 → Mg2+ + 2H2O.
C. H+ + OH – → H2O.
D. 2HCl + Mg(OH)2 → Mg2+ + 2 + 2H2O.
Đáp án: B
Giải thích:
Ta có phản ứng: Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
Phương trình ion đầy đủ là:
Mg(OH)2 + 2H+ + 2 → Mg2+ + 2 + 2H2O.
→ Phương trình ion thu gọn là: Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
Câu 4:
A. Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2.
B. H2SO4 + BaCO3 → BaSO4 + CO2 + H2O.
C. Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3.
D. H2SO4 + Ba(OH)2 → BaSO4 + 2H2O.
Đáp án: C
Giải thích:
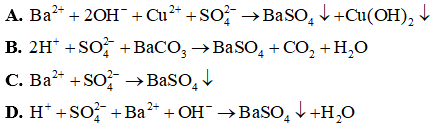
Câu 5:
A. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
B. 2HCl + FeS → FeCl2 + H2S
C. NaOH + HCl → NaCl + H2O
D. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Đáp án: C
Giải thích: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất điện li yếu, chất khí.
Câu 6:
A. K+.
B. H+.
C.
D. Fe3+.
Đáp án: A
Giải thích:
A. K+ không phản ứng được với
B.
C.
D.
Câu 7:
B. 2.
C. 3.
D. 4.
Đáp án: D
Câu 8:
(1) NaHS + NaOH
(2) Ba(HS)2 + KOH
(3) Na2S + HCl
(4) CuSO4 + Na2S
(5) FeS + HCl
(6) NH4HS + NaOH
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (3), (4), (5).
B. (1), (2).
C. (1), (2), (6).
D. (1), (6).
Đáp án: B
Giải thích:
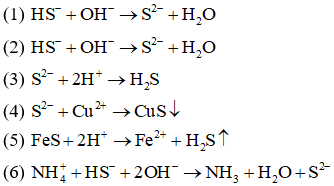
Câu 9:
(1) CaCl2 + Na2CO3
(2) Ca(OH)2 + CO2
(3) Ca(HCO3)2 + NaOH
(4) Ca(NO3)2 + (NH4)2CO3
A. (1) và (2).
B. (2) và (3).
C. (1) và (4).
D. (2) và (4).
Đáp án: C
Giải thích:
(1), (4) có cùng phương trình ion thu gọn là
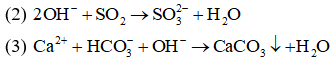
Câu 10:
A. Zn + H2SO4 ZnSO4 + H2
B. Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3
C. 2Fe(NO3)3 + 2KI 2Fe(NO3)2 + I2 + 2KNO3
D. Zn + 2Fe(NO3)3 Zn(NO3)2 + 2Fe(NO3)2
Đáp án: B
Giải thích:
A, C, D là phản ứng oxi hóa khử
B là phản ứng trao đổi ion trong dung dịch:
Câu 11:
A. NaOH + NaHCO3→ Na2CO3 + H2O
B. NaOH + HCl → NaCl + H2O
C. H2SO4 + BaCl2 → BaSO4 + 2HCl
D. 3HCl + Fe(OH)3 → FeCl3 + 3H2O
Đáp án: B
Giải thích:
Phản ứng có phương trình ion
→ Phản ứng trung hòa axit với bazơ tan sinh ra muối tan và nước.
Câu 12:
A.
B.
C.
D.
Đáp án: A
Giải thích: Phương trình ion thu gọn là:
Câu 13:
A. Na+, Cl- , S2-, Cu2+.
B. K+,OH- , Ba2+, .
C. , Ba2+, ,OH- .
D. , , Na+, .
Đáp án: D
Giải thích:
Các ion cùng tồn trong 1 dung dịch khi chúng không phản ứng với nhau.
A. Loại vì
B. Loại vì
C. Loại vì
Câu 14:
A. các chất phản ứng phải là những chất dễ tan.
B. các chất phản ứng phải là những chất điện li mạnh.
C. một số ion trong dung dịch kết hợp được với nhau tạo thành chất kết tủa hoặc chất khí hoặc chất điện li yếu.
D. phản ứng không phải là thuận nghịch.
Đáp án: C
Giải thích: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất điện li yếu, chất khí.
Câu 15:
A. 30,1.
B. 31,7.
C. 69,4.
D. 64,0.
Đáp án: A
Giải thích:
Gọi số mol CaCO3 và MgCO3 trong hỗn hợp X lần lượt là x, y mol
Phương trình:
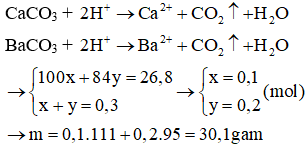
Câu 16:
A. 24,19%.
B. 51,63%.
C. 75,81%.
D. 48,37%
Đáp án: D
Giải thích:
Dung dịch X
+ 43 gam Y
Phương trình ion:
Giả sử dư
phản ứng = x + y = 0,3 mol < 0,35 mol
→ Thoả mãn
%
Câu 17:
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án: C
Giải thích: Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 18:
A. 1.
B. 12.
C. 13.
D. 2.
Đáp án: A
Giải thích:
- Xét dung dịch X
Bảo toàn điện tích ta có:
0,07 = 0,02.2 + x
→ x = 0,03 mol
- Xét dung dịch Y
Bảo toàn điện tích ta có:
0,04 = y
- Trộn X với Y → Z
Phương trình ion:
x < y→ H+dư, OH- hết
→ [H+] dư =
→ pH = -lg[H+] dư = 1
Câu 19:
A. 353.
B. 659.
C. 753.
D. 800.
Đáp án: B
Giải thích:
K2O + H2O → 2KOH
Câu 20:
A. 43,8 gam
B. 44,1 gam
C. 34,8 gam
D. 25,5 gam
Đáp án: C
Giải thích:
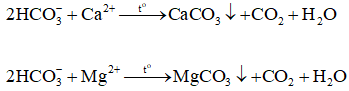
Bảo toàn điện tích ta có:
0,2.2 + 0,15.2 = 0,4 + a
→ a = 0,3 mol
→ muối khan =
→ mmuối khan = 0,2.40 + 0,15.24 + 0,4.35,5 + 0,15.60 = 34,8 gam
Câu 21:
A. tạo thành chất kết tủa.
B. tạo thành chất khí
C. tạo thành chất điện li yếu.
D. hoặc A, hoặc B, hoặc C.
Đáp án: D
Giải thích:
Phản ứng trao đổi trong dung dịch các chất điện li chỉ có thể xảy ra khi có ít nhất một trong các điều kiện sau:
- Tạo thành chất kết tủa
- Tạo thành chất khí
- Tạo thành chất điện li yếu
Câu 22:
A. 0,05
B. 0,1
C. 0,15
D. 0,20
Đáp án: B
Giải thích:
Phương trình hóa học:
Gọi số mol mỗi ion và là x mol
→ 197x + 233x = 43
→ x = 0,1 mol
Câu 23:
A. 3,52
B. 3,73
C. 7,04
D. 7,46
Đáp án: D
Giải thích:
- Phần 1:
- Phần 2:
Áp dụng định luật bảo toàn điện tích ta có:
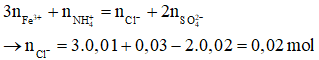
- Tổng khối lượng muối khan khi cô cạn dung dịch X là:
m = mcation + manion
→ m = 2.(0,01.56 + 0,03.18 + 0,02.35,5 + 0,02.96) = 7,46 gam
Câu 24:
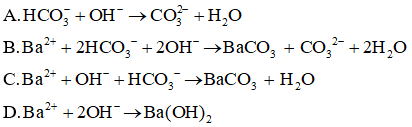
Đáp án: B
Giải thích:
Phương trình ion rút gọn:
![]()
Câu 25:
A. 39,4.
B. 17,1.
C. 15,5.
D. 19,7.
Đáp án: D
Giải thích:
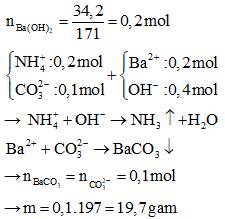
Câu 26:
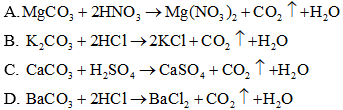
Đáp án: B
Giải thích:
Phương trình ion rút gọn
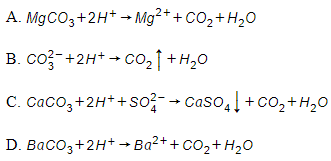
Câu 27:
A. pH=14.
B. pH=13.
C. pH=12.
D. pH= 9.
Đáp án: B
Giải thích:
→ H+ hết, OH- dư
Sau phản ứng có:
[OH-] =
→ pH = 14 + lg[OH-] = 13
Câu 28:
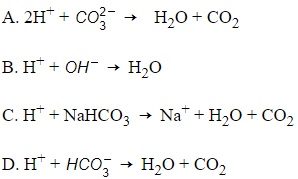
Đáp án: D
Giải thích: H+ + H2O + CO2
Câu 29:
A.
B.
C. H+, Ba2+, Al3+
D.
Đáp án: D
Giải thích:
A loại vì không phản ứng với OH-
B loại vì không phản ứng với OH-.
C loại vì không phản ứng với OH-.
D thỏa mãn.
Câu 30:
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: C
Giải thích:
Ba(OH)2 →
1.
2.
3.
4.
Bài 31: Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 6,72 lít khí (đktc) và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 69,4.
D. 64,0.
Đáp án: A
Bài 32: Cho 47 gam K2O vào m gam dung dịch KOH 14%, thu được dung dịch KOH 21%. Giá trị của m là
A. 353.
B. 659.
C. 753.
D. 800.
Đáp án: B
Bài 33: Để pha được 1 lít dung dịch chứa Na2SO4 0,04M, K2SO4 0,05 M và KNO3 0,08M cần lấy
A. 12,15 gam K2SO4 và 10,2 gam NaNO3.
B. 8,08 gam KNO3 và 12,78 gam Na2SO4.
C. 15,66 gam K2SO4 và 6,8 gam NaNO3.
D. 9,09 gam KNO3 và 5,68 gam Na2SO4.
Đáp án: C
Bài 34: Hòa tan một hỗn hợp 7,2 gam gồm hai muối sunfat của kim loại A và B vào nước được dung dịch X. Thêm vào dung dịch X môt lượng vừa đủ BaCl2 đã kết tủa ion SO42-, thu được 11,65 gam BaSO4 và dung dịch Y. Tổng khối lượng hai muối clorua trong dung dịch Y là
A. 5,95 gam.
B. 6,5 gam.
C. 7,0 gam.
D. 8,2 gam.
Đáp án: A
Bài 35: Cho 1 lít dung dịch gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng với 43 gam hỗn hợp rắn Y gồm BaCl2 và CaCl2. Sau khi phản ứng kết thúc, thu được 39,7 gam kết tủa. Tỉ lệ khối lượng của BaCl2 trong Y là
A. 24,19%.
B. 51,63%.
C. 75,81%.
D. 48,37%
Đáp án: D
Bài 36: Cho dung dịch Fe2(SO4)3 phản ứng với dung dịch Na2CO3 thì sản phẩm tạo ra là:
A. Fe2(CO3)3 và Na2SO4
B. Na2SO4; CO2 và Fe(OH)3
C. Fe2O3; CO2; Na2SO4 và CO2
D. Fe(OH)3; CO2; Na2SO4; CO2
Đáp án: B
Bài 37: Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án: C
Bài 38: Các ion nào sau không thể cùng tồn tại trong một dung dịch
A. Na+, Mg2+, NO3-, SO42-.
B. Ba2+, Al3+, Cl-, HSO4-.
C. Cu2+, Fe3+, SO42-, Cl-.
D. K+, NH4+, OH-, PO43-.
Đáp án: B
Bài 39: Các ion có thể tồn tại trong cùng một dung dịch là:
A. Na+, NH4+, SO42-, Cl-.
B. Mg2+, Al3+, NO3-, CO32-.
C. Ag+, Mg2+, NO3-, Br-.
D. Fe2+, Ag+, NO3-, CH3COO-.
Đáp án: A
Bài 40: Dung dịch X có chứa 0,07 mol Na+, 0,02 mol SO42-, và x mol OH-. Dung dịch Y có chứa ClO4-, NO3- và y mol H+; tổng số mol ClO4-, NO3- là 0,04 mol. Trộn X và T được 100 ml dung dịch Z. Dung dịch Z có pH (bỏ qua sự điện li của H2O) là :
A. 1.
B. 12.
C. 13.
D. 2.
Đáp án: A
Các câu hỏi trắc nghiệm Hóa học lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Xicloankan có đáp án