Anonymous
0
0
TOP 40 câu Trắc nghiệm Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (có đáp án 2023) – Hóa 11
- asked 6 months agoVotes
0Answers
1Views
Trắc nghiệm Hóa 11 Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài giảng Hóa 11 Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu 1:
A.
B.
C.
D.
Đáp án: D
Giải thích:
A. H2S
B. H2O
C. Mg(OH)2
D. K2CO3
Câu 2:
A. NaCl, HCl, NaOH
B. HF, C6H6, KCl
C. H2S, H2SO4, NaOH
D. H2S, CaSO4, NaHCO3
Đáp án: A
Giải thích:
Chất điện li mạnh bao gồm: axit mạnh, bazơ mạnh và hầu hết các muối.
→ NaCl, HCl, NaOH là chất điện li mạnh.
Câu 3:
A. NaOH.
B. NaHCO3.
C. Na2SO4.
D. NaHSO4.
Đáp án: C
Giải thích: Muối trung hòa là muối không có khả năng phân li ra H+.
Câu 4:
A. AlCl3.
B. Fe(OH)2.
C. HCl.
D. Al(OH)3.
Đáp án: D
Giải thích:
Al(OH)3 có tính lưỡng tính vì vừa tác dụng với axit và bazơ
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
Câu 5:
A. NaCl
B. NaH2PO4.
C. NaOH.
D. NaNO3.
Đáp án: B
Giải thích:
A, D là muối trung hòa
C là bazơ
B là muối axit vì gốc axit có khả năng phân li ra ion H+.
Câu 6:
A.
B.
C.
D. NaOH
Đáp án: D
Giải thích:
Câu 7:
A.
B. (fructozơ).
C. NaOH.
D. HCl.
Đáp án: B
Giải thích:
không phân li
Câu 8:
A.
B.
C.
D.
Đáp án: D
Giải thích:
- Loại A vì
- Loại B vì
- Loại C vì
Câu 9:
A. KOH
B. HNO3
C. CH3COOH
D. NH4Cl
Đáp án: C
Giải thích: CH3COOH
Câu 10:
A. KCl
B. CH3CHO
C. Cu
D. C6H12O6 (glucozơ)
Đáp án: A
Giải thích:
Chất điện li: là chất mà khi tan trong nước, các phân tử hòa tan đều phân li hoàn toàn ra ion.
→ chỉ có KCl trong các chất trong dãy là chất điện li (chất điện li mạnh).
Câu 11:
A. OH- và 0,03.
B. Cl- và 0,01.
C. và 0,03.
D. và 0,03.
Đáp án: D
Giải thích:
Giả sử ion Y có dạng
Áp dụng định luật bảo toàn điện tích ta có:
+ n = 1 → a = 0,03 → A, D thỏa mãn nhưng các ion không được phản ứng với nhau → loại A vì
→ D thỏa mãn.
Câu 12:
A. C2H5OH.
B. NaHCO3.
C. KOH.
D. H2SO4.
Đáp án: A
Giải thích: C2H5OH không phải chất điện li vì ancol etylic tan trong nước nhưng không phân li thành các ion.
Câu 13:
A. NaClO4, HCl, NaOH
B. HF, C6H6, KCl.
C. H2S, H2SO4, NaOH
D. H2S, CaSO4, NaHCO3.
Đáp án: A
Giải thích:
B loại vì HF là chất điện li yếu và C6H6 không là chất điện li.
C loại vì H2S là chất điện li yếu.
D loại vì H2S là chất điện li yếu.
Câu 14:
A.
B.
C.
D.
Đáp án: C
Giải thích:
A loại vì
B loại vì
D loại vì và
Câu 15:
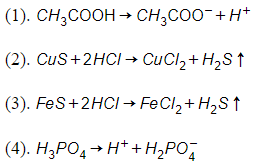
Số phương trình được viết đúng là :
A. 1
B. 2
C. 3
D. 4.
Đáp án: A
Giải thích:
(1) sai
(2) sai vì không xảy ra phản ứng.
(3) đúng
(4) sai
Câu 16:
A. và 0,4.
B. OH- và 0,2.
C. OH- và 0,4.
D. và 0,2.
Đáp án: A
Giải thích:
Vì có Mg2+ nên dung dịch không có OH-
→ Loại B và C.
→ Y- là
Áp dụng định luật bảo toàn điện tích ta có :
0,1.1 + 0,2.2 + 0,1. 1 = 0,2.1 + a.1
→ a = 0,4 mol
Câu 17:
A.
B.
C.
D.
Đáp án: D
Giải thích:
Câu 18:
A.
B.
C.
D.
Đáp án: B
Giải thích:
A. và
C.
D.
Câu 19:
A. tăng
B. giảm
C. không biến đổi
D. không xác định được.
Đáp án: B
Giải thích:
HCl →
Khi thêm vài giọt dung dịch HCl vào
→ [H+] tăng
→ Cân bằng dịch chuyển sang trái
→ Độ điện li giảm
Câu 20:
A. 0,75M.
B. 1M.
C. 0,25M.
D. 0,5M.
Đáp án: D
Giải thích:
Phương trình hóa học:
KOH + HCl → KCl + H2O
Giả sử KOH phản ứng hết
→
→ Giả sử sai
→ KOH dư, HCl hết
Gọi nồng độ của axit HCl là a (mol/l)
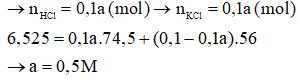
Câu 21:
A.
B.
C.
D.
Đáp án: A
Giải thích:
B loại vì
C loại vì và
D loại vì
Câu 22:
A. 0,12
B. 0,08.
C. 0,02.
D. 0,10.
Đáp án: C
Giải thích:
100 ml dung dịch HCl có pH = 1
→ [H+] = 0,1M
→
Sau khi trộn thu được 200ml dung dịch có pH = 12 > 7
→ H+ hết, OH- dư
pOH = 2→ [OH-] = 0,01M
→ dư = 0,01.0,2 = 0,002 mol
→ 0,002 = 0,1.(0,1 + a) – 0,01
→ a = 0,02 M
Câu 23:
A. xuất hiện kết tủa vàng
B. xuất hiện kết tủa trắng.
C. xuất hiện bọt khí không mầu.
D. xuất hiện bọt khí màu nâu đỏ.
Đáp án: B
Giải thích:
Hiện tượng khi cho khoảng 2 ml dung dịch Na2CO3 đặc vào ống nghiệm đựng khoảng 2 ml dung dịch CaCl2 là xuất hiện kết tủa trắng.
Câu 24:
A. 7.
B. 2.
C. 1.
D. 6.
Đáp án: B
Giải thích:
Câu 25:
A. 6.
B. 5.
C. 7.
D. 4.
Đáp án: A
Giải thích:
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Ba(HCO3)2 + Na2CO3 → BaCO3↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4↓ + K2SO4 + CO2↑ + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3↓ + CaCO3↓ + 2 H2O
Ba(HCO3)2 + H2SO4 → BaSO4↓ + 2CO2↑ + 2H2O
Câu 26:
A. H2O, CH3COOH, CuSO4
B. CH3COOH, CuSO4
C. H2O, CH3COOH
D. H2O, NaCl, CH3COOH , CuSO4
Đáp án: C
Giải thích:
Chất điện li yếu là chất tan trong nước nhưng chỉ một phần bị phân li thành ion.
→ Chất điện li yếu gồm: H2O và CH3COOH
Câu 27:
A. chỉ thu được dung dịch trong suốt không màu.
B. chỉ thu được dung dịch trong suốt màu xanh lam.
C. xuất hiện bọt khí không màu.
D. xuất hiện bọt khí màu lục.
Đáp án: C
Giải thích:
Hiện tượng khi hòa tan CaCO3 bằng dung dịch HCl loãng là thấy xuất hiện bọt khí không màu.
Phương trình ion thu gọn:
CaCO3
Câu 28:
A. đỏ, hồng, xanh nhạt.
B. hồng, xanh đậm, xanh nhạt.
C. hồng, xanh nhạt, xanh đậm.
D. xanh đậm, xanh nhạt và hồng.
Đáp án: C
Giải thích:
- Axit CH3COOH là axit yếu → quỳ tím chuyển sang màu hồng
CH3COOH
- NH3 có tính bazơ yếu
NH3 + H2O
→ Quỳ tím chuyển sang màu xanh nhạt do nồng độ OH- thấp.
- NaOH là bazơ mạnh
NaOH →
→ Quỳ tím chuyển sang màu xanh đậm hơn.
Câu 29:
A. a + 2b = c + d
B. a + 2b = 2c + d
C. a + b = 2c + d
D. a + b = c + d
Đáp án: B
Giải thích:
Áp dụng định luật bảo toàn điện tích ta có:
Tổng số mol điện tích cation = Tổng số mol điện tích anion
→ a + 2b = 2c + d
Câu 30:
B. 100.
C. 20.
D. 10.
Đáp án: D
Giải thích:
Gọi V, V’ lần lượt là thể tích dung dịch axit HCl trước và sau pha loãng.
Trước khi pha loãng có pH = 3
→ [ H+] =
→
Sau khi pha loãng có pH = 4
→ [ H+] =
→
Mà số mol H+ không đổi
→
→ Cần pha loãng gấp 10 lần.
Các câu hỏi trắc nghiệm Hóa học lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Xicloankan có đáp án