Anonymous
0
0
Lý thuyết Axit cacboxylic (mới 2023 + Bài Tập) Axit cacboxylic
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 11 Bài 45: Axit cacboxylic
Bài giảng Hóa 11 Bài 45: Axit cacboxylic
I. Định nghĩa, phân loại, danh pháp
1. Định nghĩa
- Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
- Ví dụ: H-COOH, C2H5COOH, HOOC-COOH
- Nhóm cacboxyl (-COOH) là nhóm chức của axit cacboxylic.
2. Phân loại
Dựa theo đặc điểm cấu tạo của gốc hiđrocacbon và số nhóm cacboxyl trong phân tử, các axit được chia thành:
- Axit no, đơn chức mạch hở, tổng quát (thường gặp):
CnH2n+1COOH (n ≥ 0) hay CmH2mO2 (m ≥ 1)
- Axit không no, đơn chức, mạch hở:
- Axit thơm, đơn chức:
- Axit đa chức:
3. Danh pháp
a) Tên thường
Một số axit có tên thông thường liên quan đến nguồn gốc tìm ra chúng. Ví dụ:
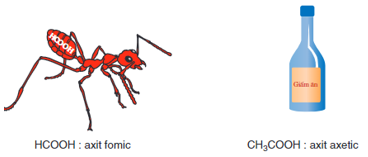
b) Tên thay thế
Tên thay thế của các axit no, đơn chức, mạch hở được xác định như sau:
+ Mạch chính của phân tử axit là mạch dài nhất, bắt đầu từ nhóm – COOH.
+ Mạch cacbon được đánh số bắt đầu từ nguyên tử cacbon của nhóm – COOH.
+ Tên thay thế =Axit + tên hiđrocacbon no tương ứng với mạch chính + oic.
Ví dụ:
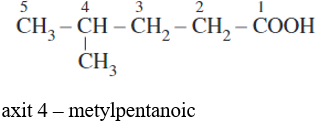
II. Đặc điểm cấu tạo
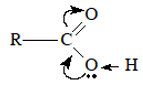
- Nhóm -COOH coi như được kết hợp bởi nhóm C = O và nhóm – OH.
- Liên kết O -H trong phân tử axit phân cực hơn liên kết O–H trong phân tử ancol, do đó nguyên tử H của nhóm COOH linh động hơn nguyên tử H của nhóm – OH ancol.
- Liên kết C- OH của nhóm cacboxyl phân cực mạnh hơn liên kết C – OH của ancol, phenol nên nhóm – OH của axit cacboxylic cũng dễ bị thay thế.
III. Tính chất vật lý
-Ở điều kiện thường các axit cacboxylic đều là những chất lỏng hoặc rắn.
- Nhiệt độ sôi tăng theo chiều tăng M và cao hơn các ancol có cùng M: nguyên nhân là do giữa các phân tử axit cacboxylic có liên kết hiđro bền hơn liên kết hidro giữa các phân tử ancol.
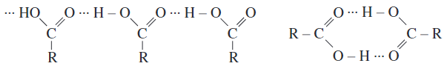
- Mỗi axit có vị riêng: axit axetic có vị giấm ăn, axit oxalic có vị chua của me …
IV. Tính chất hóa học
1.Tính axit
- Trong dung dịch, axit cacboxylic phân li thuận nghịch:
CH3COOH ⇄ H+ + CH3COO-
Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ
- Tác dụng với bazơ, oxit bazơ tạo thành muối và nước. Ví dụ:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
- Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
- Tác dụng với kim loại trước hiđro:
2CH3COOH + Zn → (CH3COO)2Zn + H2
2. Phản ứng thế nhóm –OH
- Phản ứng giữa axit và ancol tạo thành este và nước được gọi là phản ứng este hóa.
- Tổng quát:
RCOOH + R’OH RCOOR’ + H2O
- Đặc điểm: phản ứng thuận nghịch, xúc tác H2SO4 đặc.
- Ví dụ:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
V. Điều chế
1. Phương pháp lên men giấm: (phương pháp cổ truyền sản xuất axit axetic)
C2H5OH + O2 CH3COOH + H2O
2. Oxi hóa anđehit axetic:
2CH3CHO + O2 2CH3COOH
3.Oxi hóa ankan:
2R-CH2-CH2-R’ + 5O2 2RCOOH + 2R’COOH + 2H2O
4.Từ metanol:
CH3OH + CO CH3COOH
Đây là phương pháp hiện đại để sản xuất axit axetic.
VI. Ứng dụng
Các axit hữu cơ có ứng dụng trong nhiều lĩnh vực: làm nguyên liệu cho công nghiệp mĩ phẩm, công nghiệp dệt, công nghiệp hóa học …

Trắc nghiệm Hóa học lớp 11 Bài 45: Axit cacboxylic
Bài 1:
A.HCOOH.
B.C2H5COOH.
C.CH3COOH.
D.A hoặc B hoặc C.
Đáp án: C
Giải thích:
Khối lượng bình 1 tăng chính là khối lượng H2O, khối lượng bình 2 tăng chính là khối lượng CO2.
Theo bài ra ta lại có:
nCO2 = nH2O = 0,1 mol
BTKL:
mO = 3 – 0,1.12 – 0,1.2= 1,6 g
=> nO = 0,1 mol
Bảo toàn O có
nX =
Vậy công thức cấu tạo của X là CH3COOH.
Bài 2:
A.HOOC-COOH
B.HOOC-CH2-COOH
C.HOOC-C(CH2)2-COOH
D.HOOC-(CH2)4-COOH
Đáp án: D
Giải thích:
Do axit đa chức => có 2 nhóm COOH trở lên
Mà axit mạch thằng => có không quá 2 nhóm COOH
=> Axit no, 2 chức, mạch thẳng CnH2n-2O4
=>naxit = nCO2 – nH2O = 0,1 mol
=> n = 6 => CTPT C6H10O4
=> HOOC-(CH2)4-COOH
Bài 3:
A.HCOOH.
B.CH3COOH.
C.HOOC - COOH.
D.HOOC - CH2- COOH.
Đáp án: C
Giải thích:
Ta có sơ đồ:
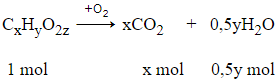
=> x + 0,5y = 3
=> x = 2 và y =2 thỏa mãn.
Vậy công thức cấu tạo của A là HOOC - COOH.
Bài 4:
A.3,0 gam.
B.4,6 gam.
C.7,4 gam.
D.6,0 gam.
Đáp án: D
Giải thích:
Tăng giảm khối lượng
=> n axit = mol
=> = 67
=> X chứa CH3COOH và C2H5COOH
Gọi số mol CH3COOH và C2H5COOH lần lượt là x và y
=> x + y = 0,2 và 60x + 74y = 13,4
=> x = 0,1
Bài 5:
A.axit fomic.
B.metyl fomat.
C.axit axetic.
D.ancol propylic.
Đáp án: C
Giải thích:
X phản ứng được với Na, NaOH, NaHCO3 nên X là axit.
Lại có MX = 60. Vậy X là axit axetic (CH3COOH).
Bài 6:
A.HCOOH và C2H5COOH.
B.CH3COOH và C2H5COOH.
C.HCOOH và HOOC - COOH.
D.CH3COOH và HOOC - CH2 - COOH.
Đáp án: C
Giải thích:
0,3 mol X + 0,5 mol NaOH
=> X chứa 0,2 mol axit 2 chức và 0,1 mol axit đơn chức
Số C trung bình là = 1,67
=> Axit đơn chức là HCOOH
=> Số C của axit còn lại là
=> Axit HOOC-COOH
Bài 7:
A. 46,67%
B.40%
C.25,41%
D.74,59%
Đáp án: C
Giải thích:
Đốt a mol X a mol H2
=> Cả Y và Z đều chứa 2 nguyên tử H
a mol X + Na2CO3 1,6a mol CO2
=> Y là axit đơn chức, Z là axit 2 chức
Từ đó, Y là HCOOH; Z là HOOC-COOH
Dễ thấy nHOOC-COOH = 0,6a mol ;
nHCOOH = 0,4a mol
=> % m HCOOH = %
Bài 8:
A.HCOOH.
B.HOOC - COOH.
C.CH3COOH.
D.B và C đúng.
Đáp án: D
Giải thích:
1A 2CO2
=> A chứa 2 nguyên tử C
Theo các đáp án đã cho
=> A là HOOC-COOH hoặc CH3COOH.
Bài 9:
A.C4H8O2.
B.C5H10O2.
C.C2H6O2.
D.C2H4O2.
Đáp án: A
Giải thích:
Khối lượng bình 1 tăng là khối lượng H2O; khối lượng bình 2 tăng là khối lượng CO2.
Ta có:
Vậy axit là no, đơn chức, mạch hở: CnH2nO2
BTKL:
Bảo toàn nguyên tố O có:
Vậy công thức phân tử của axit là C4H8O2.
Bài 10:
A. 0,3
B.0,2
C.0,6
D.0,8
Đáp án: C
Giải thích:
- Xét phản ứng của hỗn hợp X với NaHCO3:
Bảo toàn nguyên tố:
n-COOH trong X = nCO2 = 0,7 mol
=> n O trong X = 1,4 mol
- Xét phản ứng đốt cháy hỗn hợp X:
BTNT:
nO trong X + 2nO2 = 2nCO2 + nH2O
=> nH2O = 1,4 + 0,4.2 - 0,8.2
= 0,6 mol.