Anonymous
0
0
Lý thuyết Anđehit – Xeton (mới 2023 + Bài Tập) - Hóa học 11
- asked 6 months agoVotes
0Answers
2Views
Lý thuyết Hóa 11 Bài 44: Anđehit – Xeton
Bài giảng Hóa 11 Bài 44: Anđehit – Xeton
A. Anđehit
I. Định nghĩa, phân loại, danh pháp
1. Định nghĩa
- Anđehit là những hợp chất hữu cơ mà phân tử có nhóm – CH = O (hay – CHO) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
- Nhóm chức – CHO là nhóm chức anđehit.
- Ví dụ:
HCHO; CH3CHO; OHC – CHO…
2. Phân loại
- Dựa theo đặc điểm cấu tạo của gốc hiđrocacbon, anđehit được chia thành:
+ Anđehit no;
+ Anđehit không no;
+ Anđehit thơm.
- Dựa theo số nhóm -CHO trong phân tử, anđehit được chia thành:
+ Anđehit đơn chức
+ Anđehit đa chức
Chú ý:
Anđehit no, mạch hở, đơn chức có công thức cấu tạo thu gọn CxH2x+1CHO (x ≥ 0) hay công thức phân tử chung CnH2nO (n ≥ 1).
3. Danh pháp
a) Tên thông thường
- Một số anđehit có tên thông thường.
- Tên thông thường = anđehit + tên axit tương ứng
- Ví dụ:
HCHO: anđehit fomic
CH3CHO: anđehit axetic
b) Tên thay thế của các anđehit no, đơn chức, mạch hở:
- Chọn mạch chính của phân tử anđehit là mạch cacbon dài nhất có chứa nhóm -CHO.
- Đánh số thứ tự C trên mạch chính, bắt đầu từ nhóm – CHO.
- Tên thay thế = tên hiđrocacbon tương ứng với mạch chính + al
- Ví dụ:
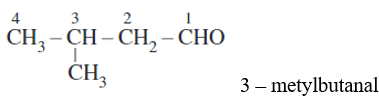
II. Đặc điểm cấu tạo và tính chất vật lý
1. Đặc điểm cấu tạo
Trong nhóm – CHO, liên kết đôi C = O gồm một liên kết σ bền và một liên kết π kém bền hơn, tương tự liên kết C = C trong phân tử anken, do đó anđehit có một số tính chất giống anken.
2. Tính chất vật lý
- Ở điều kiện thường, các anđehit đầu dãy đồng đẳng là chất khí và tan tốt trong nước. Các anđehit tiếp theo là chất lỏng hoặc rắn.
- Độ tan trong nước của các anđehit giảm dần theo chiều tăng của phân tử khối.
III. Tính chất hóa học
1. Phản ứng cộng hiđro
Ví dụ:
CH3 – CH = O + H2 CH3 – CH2 – OH
Phản ứng tổng quát:
RCHO + H2 RCH2OH
⇒ Trong phản ứng này anđehit đóng vai trò là chất oxi hóa.
2. Phản ứng oxi hóa không hoàn toàn
- Phản ứng tráng gương
Ví dụ:
CH3CHO + 2AgNO3 + H2O + 3NH3 CH3COONH4 + 2NH4NO3 + 2Ag↓
Phản ứng tổng quát:
RCHO + 2AgNO3 + H2O + 3NH3 RCOONH4 + 2NH4NO3 + 2Ag↓
- Phản ứng tạo thành axit
2RCHO + O2 2RCOOH
⇒ Trong các phản ứng trên anđehit đóng vai trò là chất khử.
3. Phản ứng oxi hóa hoàn toàn
Phản ứng tổng quát khi đốt cháy hoàn toàn anđehit no, đơn chức, mạch hở:
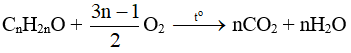
IV: Điều chế
1. Từ ancol
Oxi hóa ancol bậc I, được anđehit tương ứng:
RCH2OH + CuO RCHO + Cu + H2O
2. Từ hiđrocacbon
- Oxi hóa metan có xúc tác thu được anđehit fomic
CH4 + O2 HCHO + H2O
- Oxi hóa không hoàn toàn etilen là phương pháp hiện đại để sản xuất anđehit axetic
2CH2= CH2 + O2 2CH3CHO
V: Ứng dụng
- Fomanđehit được dùng làm nguyên liệu sản xuất nhựa phenol – fomanđehit và nhựa ure – fomanđehit.
- Dung dịch nước của fomanđehit được dùng làm chất tẩy uế, ngâm mẫu động vật làm tiêu bản …
- Anđehit axetic được dùng làm nguyên liệu sản xuất axit axetic.
- Nhiều anđehit có nguồn gốc thiên nhiên được dùng làm hương liệu cho công nghiệp thực phẩm, mĩ phẩm …
B. Xeton
I. Định nghĩa
- Xeton là những hợp chất hữu cơ mà phân tử có nhóm ![]() liên kết trực tiếp với hai nguyên tử cacbon.
liên kết trực tiếp với hai nguyên tử cacbon.
Ví dụ:
CH3 – CO – CH3: đimetyl xeton.
II. Tính chất hóa học
- Giống anđehit, xeton cộng hiđro tạo thành ancol. Tổng quát:
R – CO – R1 + H2 R – CH(OH) – R1
Ví dụ:
CH3 – CO – CH3 + H2 CH3 – CH(OH) – CH3
- Khác với anđehit, xeton không tham gia phản ứng tráng bạc.
III. Điều chế
1. Từ ancol
Oxi hóa không hoàn toàn ancol bậc II được xeton. Ví dụ:
CH3 – CH(OH) – CH3 + CuO CH3 – CO – CH3 + Cu + H2O
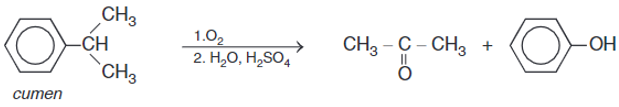
2. Từ hiđrocacbon
Oxi hóa không hoàn toàn cumen được axeton và phenol theo sơ đồ:
Trắc nghiệm Hóa học lớp 11 Bài 44: Anđehit - xeton
Bài 1:
A.C3H4O.
B.C4H6O.
C.C4H6O2.
D.C8H12O
Đáp án: C
Giải thích:
nO2 = 0,1125 mol;
nCO2 = 0,1 mol;
nH2O = 0,075 mol;
BTNT "C": nC(A) = nCO2 = 0,1 mol
BTNT "H": nH(A) = 2nH2O = 0,15 mol
BTNT "O": nO(A) + 2nO2 = 2nCO2 + nH2O
=> nO(A) + 2.0,1125 = 2.0,1 + 0,075
=> nO(A) = 0,05 mol
=> nC : nH : nO
= 0,1 : 0,15 : 0,05
= 2 : 3 : 1
=> A có công thức đơn giản nhất là C2H3O.
Vậy đáp án C thỏa mãn.
Bài 2:
A.Tăng 18,6 gam.
B.Tăng 13,2 gam.
C.Giảm 11,4 gam.
D.Giảm 30 gam.
Đáp án: C
Giải thích:
Ta có:
MT = MX + 3.M-CH2-
= MX + 3.14
Mà MT = 2,4MX
MX = 30 (HCHO)
Vậy Z là CH3CH2CHO
Đốt 0,1 mol Z
=> nCO2 = nH2O
= 0,3 mol = nCaCO3 (vì Ca(OH)2 dư)
=> Δm dd = mCO2 + mH2O - mCaCO3
= 0,3.(44 + 18) - 30
= -11,4 gam < 0
Vậy khối lượng của dung dịch giảm 11,4 gam
Bài 3:
A.HCHO và CH3CHO
B.CH3CHO và CH3CH2CHO
C.CH2=CHCHO và CH2=CHCH2CHO
D.OHC-CH2-CH2-CHO và OHC-(CH2)3-CHO
Đáp án: C
Giải thích:
nCO2 = 0,36 mol; nH2O = 0,26 mol
Ta thấy: nCO2 - nH2O = nX nên 2 andehit đơn chức, không no có 1 nối đôi C=C.
Số nguyên tử C trung bình = nCO2 : nX
= 0,36 : 0,1 = 3,6
Do 2 anđehit là đồng đẳng kế tiếp do đó 2 anđehit là: CH2=CHCHO và CH2=CHCH2CHO
Bài 4:
A.35,00%.
B.65,00%.
C.53,85%.
D.46,15%.
Đáp án: D
Giải thích:
Ta thấy, số mol của các nguyên tố trong X, Y là giống nhau
=> Khi đốt Y tương tự như đốt cháy X.
BTNT C: nCO2 = nHCHO = 0,35 mol
BTNT H: nH2O = nHCHO + nH2 = 0,65 mol
=> nH2 = 0,65 - 0,35 = 0,3 mol
=> %VH2 = (0,3/0,65).100% = 46,15%
Bài 5:
A.10,5.
B.8,8.
C.24,8.
Đáp án: D
Giải thích:
*Phản ứng của anđehit và H2:
BTKL:
mH2 = mancol - manđehit = 1 gam
=> nH2 = 0,5 mol = nanđehit = nancol
=> nO(X) = n anđehit = 0,5 mol
*Phản ứng đốt cháy anđehit:
Do là anđehit no, đơn chức, mạch hở nên khi đốt thì nCO2 = nH2O = x mol
BTNT "O":
nO(X) + 2nO2 = 2nCO2 + nH2O
hay 0,5 + 2.0,8 = 2x + x
=> x = 0,7 mol
BTKL: mX + mO2 = mCO2 +mH2O
=> mX = 0,7.44 + 0,7.18 – 0,8.32 = 17,8 gam
Bài 6:
A.C3H6.
B.C2H4.
C.CH4.
D.C2H2.
Đáp án: B
Giải thích:
nCO2 = nH2O = 0,4 mol
Anđehit no, đơn chức, mạch hở nên khi đốt cho số mol CO2 bằng H2O
=> Đốt hiđrocacbon cũng thu được số mol CO2 bằng H2O
=> Hidrocacbon có dạng CnH2n
Mặt khác, Ctb = nCO2 : nM = 0,4 : 0,2 = 2
A. Sai vì nếu Y là C3H6 thì X là HCHO
=> nX = nY => Loại.
B. Đúng.
C. Sai vì không phải dạng CnH2n.
D. Sai vì không phải dạng CnH2n.
Bài 7:
A.C3H4O và C4H6O.
B.C3H6O và C4H8O.
C.CH2O và C2H4O.
D.C4H6O và C5H8O.
Đáp án: C
Giải thích:
Khi đốt cháy rượu nCO2 (0,15 mol) < nH2O (0,25 mol)
=> Ancol no, đơn chức, hở.
=> nancol = nH2O - nCO2 = 0,1 mol
=> Ctb ancol = nCO2 : n ancol = 0,15 : 0,1 = 1,5
=> Ancol là CH3OH và C2H5OH
=> X chứa HCHO và CH3CHO
Bài 8:
A.CH3CHO
B.C2H5CHO
C.CH2=CH-CHO
D.HCHO
Đáp án: C
Giải thích:
- Đốt cháy 0,1 mol Y thu được 0,3 mol CO2
=> Số C (trong Y) = 0,3/0,1 = 3
- Khi hidro hóa Y:
nY = 0,05 mol;
nH2 = PV/RT = = 0,1 mol
=> nH2 : nY = 0,1 : 0,05 = 2
=> Y có 2 nối đôi có thể cộng với H2.
Trong các phương án thì thấy CH2=CH-CHO thỏa mãn.
Bài 9:
A.50%.
B.40%.
C.30%.
D.20%.
Đáp án: D
Giải thích:
- Số nguyên tử C trung bình:
C tb = nCO2 : nM = 3
=> Ankin là C3H4
- Số nguyên tử H trung bình:
H tb = nH : nM
= 2nH2O : nM = 3,6
Mà ankin có H > 3,6
=> Andehit có số H < 3,6
=> có 2H
=> Andehit là C3H2O (CH≡C-CHO)
Áp dụng phương pháp đường chéo về số nguyên tử H trung bình ta có:
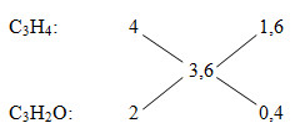
=> nC3H4 : nC3H2O = 1,6 : 0,4 = 4 : 1
Giả sử nC3H4 = 4 mol; nanđehit = 1 mol
=> %nanđehit = = 20%
Câu 10:
A.C3H7CHO.
B.CH3CHO.
C.C2H5CHO.
D.C2H3CHO.
Đáp án: A
Giải thích:
BTNT C, H:
nC = nCO2 = 0,4 mol;
nH = 2nH2O = 0,8 mol
BTKL:
mO(A) = mA - mC - mH
= 7,2 - 0,4.12 – 0,8
= 1,6 gam
=> nO = 0,1 mol
=> nC : nH : nO = 4 : 8 : 1.
Mà nAg : nA = 2 : 1
=> Phân tử A có chứa 1 nhóm -CHO
=> A có CTPT C4H8O, CTCT thu gọn là C3H7CHO