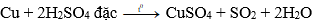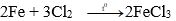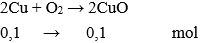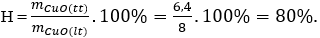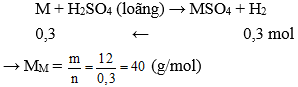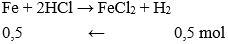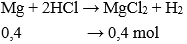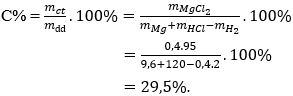Anonymous
0
0
TOP 40 câu Trắc nghiệm Tính chất hóa học của kim loại (có đáp án 2024) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa học 9 Bài 16: Tính chất hóa học của kim loại
Bài giảng Hóa học 9 Bài 16: Tính chất hóa học của kim loại
Câu 1:
A. ZnCl2, Fe(NO3)2 và CuSO4.
B. CaCl2, NaCl và Cu(NO3)2.
C. CaCl2, NaNO3 và FeCl3.
D. Ca(NO3)2, FeCl2 và CuSO4.
Đáp án: A
Giải thích:
Kim loại hoạt động hóa học mạnh hơn sẽ đẩy kim loại hoạt động yếu hơn ra khỏi muối.
Mg + ZnCl2 → MgCl2 + Zn
Mg + Fe(NO3)2 → Mg(NO3)2 + Fe
Mg + CuSO4 → MgSO4 + Cu
Câu 2:
A. Al, Fe và Cu.
B. Al, Zn và Fe.
C. Zn, Cu và Ag.
D. Zn, Al và Cu.
Đáp án: B
Giải thích: Loại A, C và D do đồng (Cu) không phản ứng với H2SO4 loãng.
Câu 3:
A. Na, Fe, K.
B. Na, K, Li.
C. Na, Li, Mg.
D. Na, Li, Fe.
Đáp án: B
Giải thích:
Kim loại kiềm phản ứng với nước ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
2Li + 2H2O → 2LiOH + H2
Câu 4:
A. Tác dụng với phi kim, tác dụng với bazơ.
B. Tác dụng với phi kim, tác dụng với bazơ, tác dụng với muối.
C. Tác dụng với phi kim, tác dụng với axit, tác dụng với dung dịch muối.
D. Tác dụng với oxit bazơ, tác dụng với axit.
Đáp án: C
Giải thích: Tính chất hóa học chung của kim loại gồm tác dụng với phi kim, tác dụng với axit và tác dụng với dung dịch muối.
Câu 5:
A. Không có hiện tượng nào xảy ra.
B. Một phần viên kẽm bị hòa tan, có một lớp màu đỏ bám ngoài viên kẽm và màu xanh lam của dung dịch nhạt dần.
C. Không có chất mới nào sinh ra, chỉ có một phần viên kẽm bị hòa tan.
D. Kim loại đồng màu đỏ bám ngoài viên kẽm, viên kẽm không bị hòa tan.
Đáp án: B
Giải thích:
Kẽm (Zn) đứng trước đồng (Cu) trong dãy điện hóa do đó đẩy được đồng ra khỏi dung dịch muối.
+ Hiện tượng: Một phần viên kẽm bị hòa tan, có một lớp màu đỏ bám ngoài viên kẽm và màu xanh lam của dung dịch nhạt dần.
+ Phương trình hóa học:
Zn + CuSO4 → Cu + ZnSO4
Câu 6:
A. Đồng (Cu).
B. Kẽm (Zn).
C. Magie (Mg).
D. Sắt (Fe).
Đáp án: C
Giải thích:
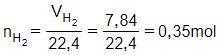
Phương trình hóa học:
M + 2HCl MCl2 + H2
Theo phương trình:
Kim loại M là Magie (Mg).
Câu 7:
A. 10%.
B. 15%.
C. 20%.
D. 25%.
Đáp án: C
Giải thích:
Phương trình hóa học:
2Na + 2H2O2NaOH + H2
Theo phương trình:
nNaOH = 0,1.2 = 0,2 mol
Khối lượng NaOH tạo thành là:
mNaOH = nNaOH MNaOH
= 0,2 40 = 8 gam
Khối lượng dung dịch thu được là:
m(dung dịch) =
m(dung dịch) = 4,6 + 35,6 -
m(dung dịch) = 4,6 + 35,6 – 0,1.2
m(dung dịch) = 40 gam
Nồng độ phần trăm dung dịch NaOH tạo thành là
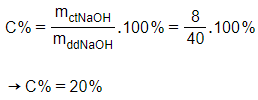
Câu 8:
A. 0,64 gam.
B. 0,32 gam.
C. 1,28 gam.
D. 0,48 gam.
Đáp án: A
Giải thích:
Phương trình hóa học:
Fe + CuSO4 Cu + FeSO4
Theo phương trình:
mCu = nCu MCu = 0,01.64 = 0,64 gam
Câu 9:
A. Cu.
B. Zn.
C. K.
D. Na.
Đáp án: C
Giải thích:
Giả sử kim loại A có hóa trị n (n = 1, 2, 3, 4)
Công thức oxit của kim loại A là A2On.
Trong hợp chất oxit của kim loại A, oxi chiếm 17,02% theo khối lượng.
Ta có bảng sau:
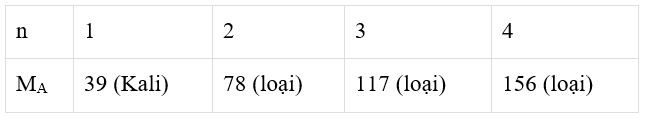
Vậy A là Kali
Câu 10:
A. Fe2O3.
B. Al2O3.
C. Cr2O3.
D. FeO.
Đáp án: B
Giải thích:
Gọi công thức của oxit là A2O3
Phương trình hóa học:
A2O3 + 6HCl 2ACl3 + 3H2O
Theo phương trình:
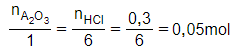
= 2.MA + 3.16
= 2MA + 48 = 102
MA = 27 A là nhôm.
Vậy oxit là Al2O3.
Câu 11:
A. Ca.
B. Mg.
C. Al.
D. Fe.
Đáp án: C
Giải thích:
Gọi kim loại M có hóa trị n (n = 1,2,3)
Phương trình hóa học:
Theo phương trình:
Ta có bảng sau:

Vậy kim loại M là Al.
Câu 12:
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 3,36 lít.
Đáp án: B
Giải thích:
Phương trình hóa học:
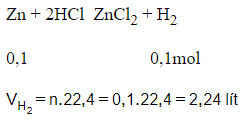
Câu 13:
A. 1,8 gam.
B. 2,7 gam.
C. 4,05 gam
D. 5,4 gam.
Đáp án: B
Giải thích:
Phương trình hóa học:
2Al + 6HCl(dư) 2AlCl3 + 3H2
Câu 14:
x… + H2SO4 → FeSO4 + y…↑.
Tổng (x + y) có thể là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: B
Giải thích:
Phương trình hóa học:
Fe + H2SO4 FeSO4 + H2
Tổng (x + y) = 1+1 = 2
Câu 15:
Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O.
Tỉ lệ x, y là
A. 1:2.
B. 2:1.
C. 3:1.
D. 1:1.
Đáp án: A
Giải thích:
- Phương trình hóa học:
Fe3O4 + 8HCl xFeCl2 + yFeCl3 + 4H2O
- Số nguyên tử Fe bên trái bằng số nguyên tử Fe bên phải
Số nguyên tử Cl bên trái bằng số nguyên tử Cl bên phải
8 = 2x + 3y (2)
Từ (1) và (2) suy ra: x = 1; y = 2.
Vậy x : y = 1 : 2.
Câu 16: Đơn chất tác dụng với dung dịch H2SO4 loãng giải phóng khí hiđro là:
A. Đồng
B. Lưu huỳnh
C. Kẽm
D. Cacbon
Đáp án: C
Giải thích:
Zn + H2SO4 (loãng) → ZnSO4 + H2
Câu 17: Dung dịch FeCl2 có lẫn tạp chất là CuCl2 có thể dùng kim loại nào sau đây để làm sạch dung dịch FeCl2 trên:
A. Zn
B. Fe
C. Mg
D. Ag
Đáp án: B
Giải thích:
Sử dụng một lượng dư kim loại Fe
Fe + CuCl2 → FeCl2 + Cu↓
Lọc bỏ kết tủa thu được dung dịch FeCl2 tinh khiết.
Câu 18: Đồng kim loại có thể phản ứng được với:
A. Dung dịch HCl
B. Dung dịch H2SO4 loãng
C. H2SO4 đặc, nóng
D. Dung dịch NaOH
Đáp án: C
Giải thích:
Câu 19: Các kim loại tác dụng được với nước ở nhiệt độ thường tạo thành dung dịch kiềm và giải phóng khí hidro:
A. Na, Ca
B. Zn, Ag
C. Cu, Ag
D. Cu, Ba
Đáp án: A
Câu 20: Lấy một ít bột Fe cho vào dung dịch HCl vừa đủ rồi nhỏ từ từ dung dịch NaOH đến dư vào dung dịch. Hiện tượng xảy ra là:
A. Có khí bay ra và dung dịch có màu xanh lam.
B. Không thấy hiện tượng gì.
C. Ban đầu có khí thoát ra và dd có kết tủa trắng xanh rồi chuyển dần thành màu nâu đỏ.
D. Có khí thoát ra và tạo kết tủa màu xanh đến khi kết thúc.
Đáp án: C
Giải thích:
Fe + 2HCl → FeCl2 + H2↑
FeCl2 + 2NaOH → Fe(OH)2 (↓ trắng xanh) + 2NaCl
4Fe(OH)2 (↓) + O2 + 2H2O → 4Fe(OH)3 (↓ nâu đỏ)
Câu 21: Hiện tượng xảy ra khi đốt sắt trong bình khí clo là:
A. Khói màu trắng sinh ra.
B. Xuất hiện những tia sáng chói.
C. Tạo chất bột trắng bám xung quanh thành bình.
D. Có khói màu nâu đỏ tạo thành.
Đáp án: D
Giải thích:
Câu 22: Nung 6,4g Cu ngoài không khí thu được 6,4g CuO. Hiệu suất phản ứng là:
A. 100%.
B. 80%.
C. 70%.
D. 60%.
Đáp án: B
Giải thích:
nCu = 6,4 : 64 = 0,1 mol
Khối lượng CuO theo lý thuyết tạo thành là : mCuO = 0,1.80 = 8 gam.
Hiệu suất phản ứng (tính theo CuO) là:
Câu 23: Hoà tan hết 12g một kim loại ( hoá trị II) bằng dung dịch H2SO4 loãng thu được 6,72 lít khí H2 (đktc). Kim loại này là:
A. Zn
B. Fe
C. Ca
D. Mg
Đáp án: C
Giải thích:
Gọi kim loại là M, tính được nkhí = 6,72 : 22,4 = 0,3 mol
Vậy kim loại cần tìm là Ca.
Câu 24: Cho vào dung dịch HCl một cây đinh sắt , sau một thời gian thu được 11,2 lít khí hiđro (đktc). Khối lượng sắt đã phản ứng là:
A. 28 gam
B. 12,5 gam
C. 8 gam
D. 36 gam
Đáp án: A
Giải thích:
nkhí = 11,2 : 22,4 = 0,5 mol
→ mFe = 0,5.56 = 28 gam.
Câu 25: Cho 9,6 gam kim loại Magie vào 120 gam dung dịch HCl (vừa đủ). Nồng độ phần trăm của dung dịch sau phản ứng là:
A. 29,32%
B. 29,5%
C. 22,53%
D. 22,67%
Đáp án: B
Giải thích:
nMg = 9,6 : 24 = 0,4 mol
Dung dịch sau phản ứng chứa MgCl2: 0,4 mol
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Dãy hoạt động của kim loại có đáp án
Trắc nghiệm Hợp kim sắt: Gang, thép có đáp án
Trắc nghiệm Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn có đáp án