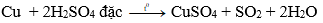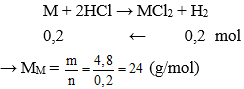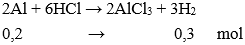Anonymous
0
0
TOP 40 câu Trắc nghiệm Dãy hoạt động của kim loại (có đáp án 2024) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa học 9 Bài 17: Dãy hoạt động hóa học của kim loại
Bài giảng Hóa học 9 Bài 17: Dãy hoạt động hóa học của kim loại
Câu 1:
A. Na, Mg, Zn.
B. Al, Zn, Na.
C. Mg, Al, Na.
D. Pb, Al, Mg.
Đáp án: A
Giải thích:
Dãy hoạt động hóa học của một số kim loại:
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
→ Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần là:
Na, Mg, Zn.
Câu 2:
A. Al , Zn, Fe
B. Zn, Pb, Au
C. Mg, Fe, Ag
D. Na, Mg, Al
Đáp án: A
Giải thích:
Các kim loại tác dụng được với Cu(NO3)2 tạo thành Cu kim loại phải đứng trước Cu trong dãy hoạt động hóa học của kim loại và các kim loại đó phải không tác dụng với nước.
Phương trình hóa học minh họa:
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Câu 3:
A. Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
B. Kim loại kiềm và kim loại kiềm thổ đều phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí H2.
C. Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4 loãng, …) giải phóng khí H2.
D. Kim loại đứng trước (trừ Na, K,…) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Đáp án: B
Giải thích:
Dãy hoạt động hóa học của kim loại cho biết
- Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
- Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí H2.
- Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4 loãng, …) giải phóng khí H2.
- Kim loại đứng trước (trừ Na, K,…) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Câu 4:
A. MgSO4
B. Al2(SO4)3
C. H2SO4 loãng
D. H2SO4 đặc, nóng
Đáp án: D
Giải thích:
Cu không phản ứng với MgSO4; Al2(SO4)3, H2SO4 loãng.
Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O
Câu 5:
A. Zn.
B. Mg.
C. Fe.
D. Cu.
Đáp án: B
Giải thích:
Cho một lượng dư Mg phản ứng với mẫu dung dịch. Đến khi phản ứng xảy ra hoàn toàn, lọc bỏ kim loại ta được dung dịch MgSO4 tinh khiết.
Phương trình hóa học:
Mg + ZnSO4 MgSO4 + Zn
Câu 6:
A. Al giải phóng hiđro nhiều hơn Zn .
B. Zn giải phóng hiđro nhiều hơn Al.
C. Al và Zn giải phóng cùng một lượng hiđro.
D. Lượng hiđro do Al sinh ra bằng 2,5 lần do Zn sinh ra .
Đáp án: A
Giải thích:
Giả sử mAl = mZn = m gam
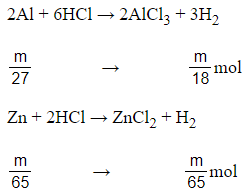
Có > . Vậy nếu hoà tan hết cùng một khối lượng Al và Zn bởi dung dịch HCl thì Al giải phóng hiđro nhiều hơn Zn.
Câu 7:
A. 8,125 gam.
B. 0,8125 gam.
C. 2,125 gam.
D. 0,2125 gam.
Đáp án: B
Giải thích:
Phương trình hóa học:
Zn + CuSO4 ZnSO4 + Cu
0,0125 ← 0,0125 (mol)
mZn pư = 0,0125.65= 0,8125 gam
Câu 8:
A. 10,8 gam.
B. 21,6 gam.
C. 1,08 gam.
D. 2,16 gam.
Đáp án: D
Giải thích:
Đặt số mol Fe phản ứng là a
Phương trình hóa học:
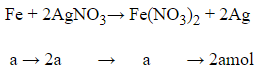
Bảo toàn khối lượng:
mFe + m Ag sinh ra – mFe(phản ứng) = 57,6
56 + 108.2a − 56a = 57,6
a = 0,01 mol
→ nAg = 2.a = 0,02 mol
→ mAg sinh ra = 0,02.108 = 2,16 gam
Câu 9:
A. Ca.
B. Mg.
C. Fe.
D. Ba.
Đáp án: B
Giải thích:
Phương trình hóa học:
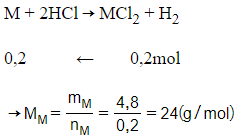
M là Magie (Mg)
Câu 10:
A. Viên natri tan dần, sủi bọt khí, dung dịch không đổi màu.
B. Viên natri tan dần,không có khí thoát ra, có kết tủa màu xanh.
C. Viên natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh.
D. Không có hiện tượng.
Đáp án: C
Giải thích:
Natri tan dần, có khí không màu thoát ra, xuất hiện kết tủa màu xanh.
Phương trình hóa học:
2Na + 2H2O 2NaOH + H2
![]()
Câu 11:
A. Fe + CuSO4 FeSO4 + Cu.
B. Fe + 2AgNO3Fe(NO3)2 + 2Ag.
C. Cu + MgSO4 CuSO4 + Mg.
D. Cu + 2AgNO3Cu(NO3)2 + 2Ag
Đáp án: C
Giải thích: Phản ứng C sai vì Cu là kim loại đứng sau Mg trong dãy hoạt động hóa học của kim loại, nên Cu không thể đẩy được Mg ra khỏi muối MgSO4.
Câu 12:
A. Mg.
B. Ba.
C. Fe.
D. Al.
Đáp án: B
Giải thích:
- Trích mẫu thử, cho vào mỗi mẫu thử một ít Ba.
- Hiện tượng:
+ Ba tan dần, có khí thoát ra → dung dịch là NaCl
Ba + 2H2O → Ba(OH)2 + H2↑
+ Có khí thoát ra, đồng thời xuất hiện kết tủa xanh → dung dịch là CuCl2.
Ba + 2H2O → Ba(OH)2 + H2↑
![]()
+ Có khí thoát ra, đồng thời xuất hiện kết tủa trắng → dung dịch là Na2SO4.
Ba + 2H2O → Ba(OH)2 + H2↑
![]()
Ngoài ra, có thể quan sát màu dung dịch để nhận ra CuCl2 (dd màu xanh); hai dung dịch còn lại không màu. Sau đó tiếp tục dùng kim loại Ba để nhận ra 2 dung dịch không màu này.
Câu 13:
A. 21,74% và 78,26%.
B. 20,74% và 79,26%.
C. 21,47% và 78,62%.
D. 20,47% và 78,26%
Đáp án: A
Giải thích:
Cho Mg và Ag tác dụng với HCl chỉ có Mg phản ứng.
Mg + 2HClMgCl2 + H2
0,25 ← 0,25 mol
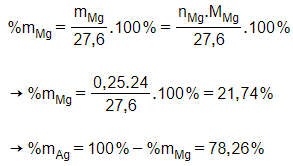
Câu 14:
A. Thanh đồng tan dần, khí không màu thoát ra
B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam
C. Không hiện tượng
D. Có kết tủa trắng
Đáp án: C
Giải thích: Do đồng đứng sau H trong dãy hoạt động hóa học của kim loại nên không tác dụng được với dung dịch H2SO4 loãng.
Câu 15:
A. 3.
B. 4.
C. 5.
D. 6.
Đáp án: B
Giải thích:
Hỗn hợp Zn và Cu tác dụng với dung dịch H2SO4, chỉ có Zn phản ứng.
Phương trình hóa học:
Zn + H2SO4(loãng)ZnSO4 + H2
Theo phương trình:
Khối lượng kẽm (Zn) phản ứng là:
mZn = nZn . MZn = 0,1.65 = 6,5gam
Khối lượng chất rắn (Cu) còn lại là:
mCu = m(Hỗn hợp) – mZn(phản ứng)
mCu = 10,5 – 6,5 = 4 gam
Câu 16: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn
B. Al, Zn, Na
C. Mg, Al, Na
D. Pb, Al, Mg
Đáp án: A
Câu 17: Từ Cu và hoá chất nào dưới đây để thu được CuSO4 ?
A. MgSO4
B. Al2(SO4)3
C. H2SO4 loãng
D. H2SO4 đặc, nóng
Đáp án: D
Giải thích:
Câu 18: Có một mẫu dung dịch MgSO4 bị lẫn tạp chất là ZnSO4, có thể làm sạch mẫu dung dịch này bằng kim loại
A. Zn
B. Mg
C. Fe
D. Cu
Đáp án: B
Giải thích:
Sử dụng một lượng dư kim loại Mg
Mg + ZnSO4 → MgSO4 + Zn ↓
Lọc bỏ kim loại thu được dung dịch MgSO4 tinh khiết.
Câu 19: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al , Zn, Fe
B. Zn, Pb, Au
C. Mg, Fe , Ag
D. Na, Mg , Al
Đáp án: A
Giải thích:
Các kim loại tác dụng được với Cu(NO3)2 tạo thành Cu kim loại phải đứng trước Cu trong dãy hoạt động hóa học của kim loại và các kim loại đó phải không tác dụng với nước.
→ A thỏa mãn.
Câu 20: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng .
Đáp án: A
Giải thích:
Sử dụng một lượng dư dung dịch NaOH
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Lọc lấy kim loại rửa sạch thu được Fe tinh khiết.
Chú ý: Một số kim loại như Al, Zn … có thể tác dụng được với dung dịch kiềm.
Câu 21: Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư , thấy thoát ra 4,48 lít khí hiđro (ở đktc). Vậy kim loại M là :
A. Ca
B. Mg
C. Fe
D. Ba
Đáp án: B
Giải thích:
nkhí = 4,48 : 22,4 = 0,2 mol
Vậy kim loại cần tìm là Mg.
Câu 22: Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng?
A. Thanh đồng tan dần, khí không màu thoát ra
B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam
C. Không hiện tượng
D. Có kết tủa trắng.
Đáp án: C
Giải thích:
Đồng đứng sau H trong dãy hoạt động hóa học của kim loại nên không tác dụng với H2SO4 loãng.
Câu 23: Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội:
A. Khí mùi hắc thoát ra
B. Khí không màu và không mùi thoát ra
C. Lá nhôm tan dần
D. Không có hiện tượng
Đáp án: D
Giải thích:
Chú ý: Một số kim loại như Al, Fe, Cr … không tác dụng với H2SO4 đặc, nguội.
Câu 24: Cho 5,4 gam nhôm vào dung dịch HCl dư , thể tích khí thoát ra (ở đktc) là:
A. 4,48 lít
B. 6,72 lít
C. 13,44 lít
D. 8,96 lít
Đáp án: B
Giải thích:
Số mol Al = 5,4 : 27 = 0,2 mol
→ Vkhí = 0,3.22,4 = 6,72 lít.
Câu 25: Cho 1 viên Natri vào dung dịch CuSO4, hiện tượng xảy ra:
A. Viên Natri tan dần, sủi bọt khí, dung dịch không đổi màu
B. Viên Natri tan dần,không có khí thoát ra, có kết tủa màu xanh
C. Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh
D. Không có hiện tượng.
Đáp án: C
Giải thích:
Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh lam
PTHH:
2Na + 2H2O → 2NaOH + H2 ↑
2NaOH + CuSO4 → Cu(OH)2 (↓ xanh) + Na2SO4.
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Hợp kim sắt: Gang, thép có đáp án
Trắc nghiệm Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn có đáp án