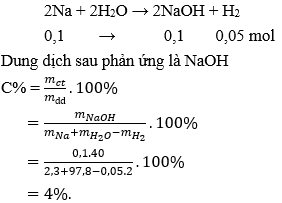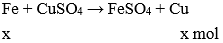Anonymous
0
0
TOP 40 câu Trắc nghiệm Luyện tập chương 2: Kim loại (có đáp án 2024) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa học 9 Bài 22: Luyện tập chương 2: Kim loại
Bài giảng Hóa học 9 Bài 22: Luyện tập chương 2: Kim loại
Câu 1:
A. Cu.
B. Pb.
C. Al.
D. Na.
Đáp án: D
Giải thích:
Dãy hoạt động hóa học của một số kim loại:
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
Vậy trong các kim loại đề bài cho thì Na hoạt động mạnh nhất.
Câu 2:
A. Ba.
B. Zn.
C. Cu.
D. Mg.
Đáp án: B
Giải thích:
Sử dụng một lượng dư kim loại kẽm cho vào dung dịch, có phản ứng hóa học sau:
Zn + CuCl2 → ZnCl2 + Cu
Kết thúc phản ứng, lọc bỏ kim loại thu được dung dịch ZnCl2 tinh khiết.
Câu 3:
A. Có tính ánh kim, nhiệt độ nóng chảy cao.
B. Dẫn điện, dẫn nhiệt, độ rắn cao.
C. Độ rắn cao, khối lượng riêng lớn.
D. Dẻo, có ánh kim, dẫn điện, dẫn nhiệt.
Đáp án: D
Giải thích: Kim loại có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
Câu 4:
A. Sắt (Fe).
B. Đồng (Cu).
C. Kali (K).
D. Bạc (Ag).
Đáp án: B
Giải thích:
Sử dụng một lượng dư kim loại đồng cho vào dung dịch, có phản ứng hóa học sau:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Kết thúc phản ứng, lọc bỏ kim loại thu được dung dịch Cu(NO3)2 tinh khiết.
Câu 5:
A. Hai kim loại và một muối.
B. Hai kim loại và hai muối.
C. Ba kim loại và một muối.
D. Ba kim loại và hai muối.
Đáp án: C
Giải thích:
Cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và AgNO3 có các phản ứng hóa học xảy ra như sau:
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
Mg + Cu(NO3)2 → Mg(NO3)2 + Cu
Sau phản ứng thu được 3 kim loại: Ag, Cu, Mg (dư) và 1 muối duy nhất Mg(NO3)2
Câu 6:
A. Không có dấu hiệu phản ứng
B. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
C. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
D. Có chất khí bay ra, dung dịch không đổi màu
Đáp án: C
Giải thích:
Nhôm đứng trước đồng trong dãy hoạt động hóa học do đó sẽ đẩy đồng ra khỏi muối
3CuSO4 + 2Al → 3Cu↓ + Al2(SO4)3
Hiện tượng: Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
Câu 7:
A. Al.
B. Fe.
C. Mg.
D. Cu.
Đáp án: D
Giải thích: Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl ⇒ chất rắn T là Cu
Câu 8:
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,4 mol.
Đáp án: B
Giải thích:
Gọi số mol CuSO4 phản ứng là x (mol).
Phương trình hóa học:
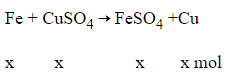
Khối lượng chất rắn tăng 1,6 gam.
m(tăng) = mCu – mFe
= MCu .nCu – MFe . nFe
1,6 = 64x – 56x = 8x
x = 0,2 (mol)
Câu 9:
A. Mg.
B. Zn.
C. Pb.
D. Fe.
Đáp án: D
Giải thích:
Gọi A là kim loại cần tìm
A + 2HCl → ACl2 + H2
0,3→ 0,3mol

⇒ A là sắt
Câu 10:
A. Fe, Al
B. Ag, Zn
C. Al, Cu
D. Al, Zn
Đáp án: D
Giải thích:
Al, Zn vừa tác dụng với HCl vừa tác dụng với KOH
Phương trình hóa học minh họa:
2Al + 6 HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 2H2O→2NaAlO2 + 3H2
Zn + 2HCl → ZnCl2 + H2
Zn + 2NaOH → Na2ZnO2 + H2
Câu 11:
A. Dung dịch NaOH dư.
B. Dung dịch H2SO4 loãng.
C. Dung dịch HCl dư.
D. Dung dịch HNO3 loãng.
Đáp án: A
Giải thích:
Sử dụng một lượng dư dung dịch NaOH
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Lọc lấy kim loại rửa sạch thu được Fe tinh khiết.
Chú ý: Một số kim loại như Al, Zn … có thể tác dụng được với dung dịch kiềm.
Câu 12:
A. 70% và 30%.
B. 10% và 90%.
C. 90% và 10%.
D. 30% và 70%.
Đáp án: C
Giải thích:
Cho Al, Ag phản ứng với H2SO4 loãng, dư chỉ có Al phản ứng:
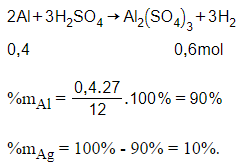
Câu 13:
A. 2,25 gam và 1,2 gam.
B. 2,55 gam và 1,2 gam.
C. 2,55 gam và 1,28 gam.
D. 2,7 gam và 3,2 gam.
Đáp án: B
Giải thích:
PTHH:
4Al + 3O2 → 2Al2O3
4 3 2
0,05 ? ?mol
Theo phương trình hóa học ta có:
Câu 14:
A. 53,4 gam.
B. 79,6 gam.
C. 80,1 gam.
D. 25,8 gam.
Đáp án: C
Giải thích:
Chỉ có Al tác dụng với HCl mới tạo ra khí H2 còn Al2O3 thì không.
Phương trình hóa học:
Xét cả 2 phương trình hóa học:
Tổng số mol AlCl3 là
Câu 15:
A. 2,7 gam.
B. 4,05 gam.
C. 5,40 gam.
D. 6,75 gam.
Đáp án: A
Giải thích:

Câu 16: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al)
B. Bạc (Ag)
C. Đồng (Cu)
D. Magie (Mg)
Đáp án: B
Câu 17: Trong các kim loại sau đây, kim loại dẻo nhất là:
A. Đồng (Cu)
B. Chì (Pb)
C. Bạc (Ag)
D. Vàng (Au)
Đáp án: D
Câu 18: Để làm sạch mẫu chì bị lẫn kẽm, ngươì ta ngâm mẫu chì này vào một lượng dư dung dịch:
A. ZnSO4
B. Pb(NO3)2
C. CuCl2
D. Na2CO3
Đáp án: B
Giải thích:
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb.
Câu 19: Dung dịch FeCl2 có lẫn tạp chất là CuCl2 có thể dùng kim loại nào sau đây để làm sạch dung dịch FeCl2 trên:
A. Zn
B. Fe
C. Mg
D. Ag
Đáp án: B
Giải thích:
Fe + CuCl2 → FeCl2 + Cu
Câu 20: Kim loại vừa tác dụng với dd HCl vừa tác dụng được với dung dịch KOH:
A. Fe, Al
B. Ag, Zn
C. Al, Cu
D. Al, Zn
Đáp án: D
Câu 21: Các kim loại tác dụng được với nước ở nhiệt độ thường tạo thành dung dịch kiềm và giải phóng khí hiđro:
A. K, Ca
B. Zn, Ag
C. Mg, Ag
D. Cu, Ba
Đáp án: A
Câu 22: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Đáp án: D
Giải thích:
Fe + CuSO4 → FeSO4 + Cu
Hiện tượng: Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 23: Hoà tan hết 2,3g Na kim loại vào 97,8g nước thu được dung dịch có nồng độ:
A. 2,4%.
B. 4,0%.
C. 23,0%.
D. 5,8%.
Đáp án: B
Giải thích:
Câu 24: Cho 4,6 g một kim loại M (hoá trị I) phản ứng với khí clo tạo thành 11,7g muối. M là kim loại nào sau đây:
A. Li
B. K
C. Na
D. Ag
Đáp án: C
Giải thích:
2M + Cl2 → 2MCl
Bảo toàn khối lượng có :
mclo = 11,7 – 4,6 = 7,1 gam → nclo = 7,1 :71 = 0,1 mol
Theo PTHH có nM = 2.nclo = 0,2 mol → MM = 4,6 : 0,2 = 23 (g/mol).
Vậy kim loại cần tìm là Na.
Câu 25: Nhúng một lá sắt vào dung dịch đồng sunfat sau một thời gian lấy lá sắt ra khỏi dung dịch cân lại thấy nặng hơn ban đầu 0,2g. Khối lượng đồng bám vào lá sắt là:
A. 0,2g
B. 1,6g
C. 3,2g
D. 6,4g
Đáp án: B
Giải thích:
Khối lượng lá sắt tăng = mCu sinh ra – mFe phản ứng → 64x – 56x = 0,2 → x = 0,025 mol
mCu sinh ra = 64.0,025 = 1,6 gam.
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Ôn tập học kì 1 có đáp án