Anonymous
0
0
TOP 40 câu Trắc nghiệm Nitơ (có đáp án 2023) – Hóa 11
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa 11 Bài 7: Nitơ
Bài giảngHóa 11 Bài 7: Nitơ
Câu 1:
A. NH4NO2.
B. HNO3.
C. không khí.
D. NH4NO3.
Đáp án: C
Giải thích: Trong công nghiệp, nitơ được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Câu 2:
A. NH3
B. NaNO2
C. NH4Cl
D. NH4NO2
Đáp án: D
Giải thích:
Trong phòng thí nghiệm, điều chế 1 lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit:
NH4NO2 N2↑ + 2H2O
Câu 3
A. Làm môi trường trơ trong một số ngành công nghiệp.
B. Bảo quản máu và các mẫu vật sinh học.
C. Sản xuất axit nitric.
D. Sản xuất phân lân.
Đáp án: D
Giải thích: Sản xuất phân lân là ứng dụng của axit H3PO4.
Câu
A. 36%.
B. 25%.
C. 50%.
D. 40%.
Đáp án: B
Giải thích:
Phương trình hóa học:
N2 + 3H2
Xét hỗn hợp X
→ Hiệu suất tính theo N2.
Giả sử nX = 5 mol →
hản ứng = x mol →phản ứng = 3x mol;
→
Câu 5:
A. Nhiệt phân NH4NO2
B. Nhiệt phân AgNO3
C. Nhiệt phân NH4NO3
D. Đốt cháy NH3 trong oxi khi có mặt chất xúc tác Pt
Đáp án: A
Giải thích:
NH4NO2 N2 + 2H2O.
Câu 6:
A. ô 14, chu kỳ 2, nhóm VA.
B. ô 14, chu kỳ 3, nhóm IIIA.
C. ô 7, chu kỳ 2, nhóm VA.
D. ô 7, chu kỳ 3, nhóm IIIA.
Đáp án: C
Giải thích: Nitơ nằm ở ô 7, chu kì 2, nhóm VA trong bảng tuần hoàn.
Câu 7:
A. Nitơ
B. Clo
C. Cacbon
D. Oxi
Đáp án: A
Giải thích: Các nguyên tố thuộc nhóm VA trong bảng tuần hoàn: N, P, As, Sb,…
Câu 8: Cấu hình electron nguyên tử của nitơ là
A. 1s22s22p1.
B. 1s22s22p5.
C. 1s22s22p63s23p2.
D. 1s22s22p3.
Đáp án: D
Giải thích:
Nguyên tử nitơ có 7 electron
→ Cấu hình electron:
Câu 9: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2 có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kém hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Đáp án: A
Giải thích:
Phân tử nitơ gồm hai nguyên tử liên kết với nhau bởi một liên kết ba. Mà liên kết ba thì rất bền, ở 3000oC chưa phân hủy rõ rệt thành các nguyên tử.
→ Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học.
Câu 10:
A. N2 + 3H2 2NH3
B. N2+6Li® 2Li3N
C. N2+O2 2NO
D.N2+3MgMg3N2
Đáp án: C
Giải thích:
Phản ứng của nitơ với oxi thì nitơ đóng vai trò là chất khử.
+O2
Câu 11:
A. Li, CuO và O2
B. Al, H2 và Mg
C. NaOH, H2 và Cl2
D. HI, O3 và Mg
Đáp án: B
Giải thích:
Nitơ phản ứng được với một số loại kim mạnh, H2 và O2.
2Al + N2 2AlN
N2+3H2 2NH3
N2+3MgMg3N2
Câu 12:
A. 1,278
B. 3,125
C. 4,125
D. 6,75
Đáp án: B
Giải thích:
Trước phản ứng: [H2] = 1M, [N2] = 1M
Sau phản ứng: [NH3] = 0,4M
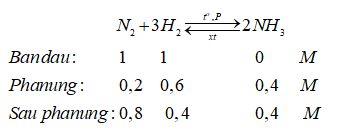
Câu 13:
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitratvào dung dịch kiềm.
Đáp án: A
Giải thích: NaNO2 + NH4Cl N2↑ + NaCl + 2H2O
Câu 14:
A. N2O.
B. NO2.
C. NO.
D. N2O5.
Đáp án: C
Giải thích:
N2 + O2 2NO
Câu 15:
A. H2.
B. O2.
C. Mg.
D. Al.
Đáp án: B
Giải thích:
+O22
Trong phản ứng này, số oxi hóa của N tăng từ 0 lên +2 → N2 đóng vai trò là chất khử.
Câu 16:
A. 37,5%.
B. 25,0%.
C. 50%.
D. 75%.
Đáp án: D
Giải thích:
N2+3MgMg3N2
→phản ứng = 1- 0,95 = 0,05 mol
→ nMg = 3phản ứng = 0,15 mol
% Mg phản ứng =
Câu 17:
A. 75%
B. 56,25%
C. 75,8%
D. kết quả khác
Đáp án: A
Giải thích:
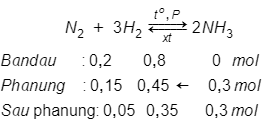
Nhận thấy: → Hiệu suất tính theo N2
→
Câu 18:
A.
B.
C.
D.
Đáp án: B
Giải thích: Không khí chứa 78,1% thể tích là N2, oxi chiếm 20,9% thể tích, 1% là hơi nước và các khí khác.
Câu 19:
A. 22,4 lít
B. 44,8 lít
C. 14 lít
D. 4,48 lít
Đáp án: C
Giải thích:
Phản ứng nhiệt phân: NH4NO2 N2 + 2H2O.
→
lít
Câu 20:
A. NH4NO2
B. NaNO3
C. NH4Cl
D. NH4NO3
Đáp án: A
Giải thích:
Trong phòng thí nghiệm, điều chế 1 lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit:
NH4NO2 N2↑ + 2H2O
Câu 21:
A. N2O.
B. NO.
C. NH3.
D. NO2.
Đáp án: B
Giải thích:
Khí NO không màu hóa nâu ngay ngoài không khí.
2NO + O2 → 2NO2
Câu 22:
A. 3 và 0
B. 1 và 0
C. 0 và 0
D. 3 và 3
Đáp án: A
Giải thích:
N2 công thức cấu tạo là : N≡NN có cộng hóa trị là 3
N2 là đơn chất N có số oxi hóa là 0
Câu 23:
A. Li
B. Cs
C. K
D. Ca
Đáp án: A
Giải thích:
Li có thể tác dụng với khí N2 ở nhiệt độ thường.
3Li + N2→ 2Li3N
Câu 24:
A. 80%
B. 50%
C. 70%
D. 85%
Đáp án: A
Giải thích:
Giả sử VA = 10 lít → VB = 6 lít
→ lít và lít
→
→ x = 2 lít
Do tỉ lệ thể tích của N2 và H2 là 1:3 → hiệu suất tính theo khí nào cũng được.
Câu 25:
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2 bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng.
Đáp án: A
Giải thích: Trong công nghiệp, khí N2 được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Câu 26:
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Đáp án: D
Giải thích:
N2 + 3H2 2NH3
Phản ứng điều chế NH3 là phản ứng thuận nghịch và tỏa nhiệt.
→ Tuân thủ theo nguyên lí Lơ Sa-tơ-li-ê
→ Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu tăng áp suất, giảm nhiệt độ.
Thực tế, thì điều kiện được áp dụng trong công nghiệp:
– Nhiệt độ: 450 – 500 Ở nhiệt độ thấp hơn, cân bằng hoá học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng.
– Áp suất cao, từ 200 đến 300 atm.
– Chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O,…
Câu 27:
A. Nitơ có bán kính nguyên tử nhỏ.
B. Nitơ có độ âm điện lớn nhất trong nhóm.
C. Phân tử nitơ có liên kết ba khá bền.
D. Phân tử nitơ không phân cực.
Đáp án: C
Giải thích: Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học do phân tử nitơ có liên kết ba khá bền.
Câu 28:
A. N2O, NO.
B. NO2, N2O5.
C. NO, NO2.
D. N2O5, HNO3.
Đáp án: C
Giải thích:
N2 + O2 2NO
2NO + O2 → 2NO2
Câu 29:
A. AgNO3.
B. Ca(OH)2.
C. H2SO4.
D. CuCl2.
Đáp án: B
Giải thích:
Để loại bỏ các khí HCl, Cl2, CO2 và SO2 cólẫntrong khíN2 người ta sử dụng lượng dư dung dịch Ca(OH)2 vì các tạp chất khí tác dụng với Ca(OH)2 bị giữ lại trong dung dịch, N2 không phản ứng sẽ thoát ra.
2HCl + Ca(OH)2 → CaCl2 + 2H2O
4Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Câu 30:
A. H.
B. O.
C. Cl.
D. F.
Đáp án: A
Giải thích: Nitơ có số oxi hóa âm trong hợp chất với nguyên tố H ().
Bài 31: Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
A. 37,5%.
B. 25,0%.
C. 50%.
D. 75%.
Đáp án: D
Bài 32: Hỗn hợp N2 và H2 trong bình phản ứng ở nhiệt độ không đổi. Sau thời gian phản ứng, áp suất các khí trong bình thay đổi 5% so với áp suất ban đầu. biết rằng số mol N2 đã phản ứng là 10%. Thành phần phần trăm số mol N2 trong hỗn hợp ban đầu là
A. 20%.
B. 25%.
C. 10%.
D. 5%.
Đáp án: D
Bài 33: Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn sô với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
A. 10%.
B. 20%.
C. 25%.
D. 5%.
Đáp án: C
Bài 34: Người ta sản xuất khi nitơ trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2 bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng
Đáp án: A
Bài 35: Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Đáp án: D
Bài 36: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. nhiệt phân NaNO2
B. Đun hỗn hợp NaNO2 và NH4Cl
C. thủy phân Mg3N2
D. phân hủy khí NH3
Đáp án: B
Bài 37: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2 + 3H2 → 2NH3
B. N2 + 6Li → 2Li3N
C. N2 + O2 → 2NO
D. N2 + 3Mg → Mg3N2
Đáp án: C
Bài 38: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2
B. Al, H2 và Mg
C. NaOH, H2 và Cl2
D. HI, O3 và Mg
Đáp án: B
Bài 39: Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
A. 15,12
B. 18,23
C. 14,76
D. 13,48
Đáp án: C
Bài 40: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
A. 1.278
B. 3,125
C. 4.125
D. 6,75
Đáp án: B
Các câu hỏi trắc nghiệm Hóa lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Amoniac và muối amoni có đáp án
Trắc nghiệm Axit nitric và muối nitrat có đáp án