Anonymous
0
0
TOP 40 câu Trắc nghiệm Amoniac và muối amoni (có đáp án 2023) – Hóa 11
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa 11 Bài 8: Amoniac và muối amoni
Bài giảng Hóa 11 Bài 8: Amoniac và muối amoni
Câu 1:
N2(khí) + 3H2(khí) 2NH3 ; = -92kJ/mol
Trong các yếu tố:
(1) Thêm một lượng N2 hoặc H2.
(2) Thêm một lượng NH3.
(3) Tăng nhiệt độ của phản ứng.
(4) Tăng áp suất của phản ứng.
(5) Dùng thêm chất xúc tác.
Có bao nhiêu yếu tố làm cho cân bằng dịch chuyển theo chiều thuận ?
A. 3
B. 4
C. 5
D. 2
Đáp án: D
Giải thích:
Các yếu tố: 1, 4.
+ (1): Thêm lượng N2 hoặc H2 → cân bằng dịch chuyển theo chiều làm giảm N2/ H2(chiều thuận)
+ (2): Thêm NH3→ cân bằng dịch chuyển theo chiều làm giảm NH3 (chiều nghịch)
+ (3): = -92 < 0 → phản ứng thuận là tỏa nhiệt → tăng nhiệt độ làm cân bằng chuyển dịch theo chiều thu nhiệt (chiều nghịch)
+ (4): Tăng áp suất của phản ứng → cân bằng dịch chuyển theo chiều giảm áp suất (chiều thuận)
+ (5): Chất xúc tác không làm ảnh hưởng đến cân bằng hóa học
Câu 2: Oxi hoá NH3 bằng CrO3 sinh ra N2, H2O và Cr2O3. Số phân tử NH3 tác dụng với một phân tử CrO3 là
A. 3.
B. 1.
C. 4.
D. 2.
Đáp án: B
Giải thích:
2NH3 + 2CrO3N2 + 3H2O + Cr2O3
→ 1 phân tử NH3 phản ứng với 1 phân tử CrO3.
Câu 3:
A. 14,76.
B. 18,23.
C. 7,38.
D. 13,48.
Đáp án: C
Giải thích:
N2 + 3H2 2NH3
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có:
=> H2 thiếu, hiệu suất phản ứng tính theo H2.
Chọn
pư = 3.40% = 1,2 mol
→ pư = 0,4 mol và sinh ra =0,8 mol.
Bảo toàn khối lượng:
→ Tỉ khối của Y với H2 là 7,38.
Câu 4:
A. NO.
B. N2O.
C. HNO3.
D. NH4Cl.
Đáp án: D
Giải thích:
Câu 5:
A. 16,04%.
B. 17,04%.
C. 18,04%.
D. 19,04%.
Đáp án: D
Giải thích:
Dễ thấy hiệu suất tính theo N2
Giả sử X→ phản ứng = 1.40% = 0,4 mol
Câu 6:
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Đáp án: D
Giải thích:
Chất dùng làm khô khí NH3 có lẫn hơi nước phải là chất có đặc tính hút nước và không phản ứng với NH3.
→ Dùng NaOH rắn để làm khô khí.
Câu 7: Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3.
B. Na2CO3.
C. NH4HCO3.
D. NH4Cl.
Đáp án: C
Giải thích: Người ta dùng muối NH4HCO3làm bột nở trong thực phẩm.
Câu 8:
A. Phenol phtalein và NaOH.
B. Cu và HCl.
C. Phenol phtalein;Cu và H2SO4 loãng .
D. Quỳ tím và dung dịch AgNO3.
Đáp án: D
Giải thích:
- Khi cho quỳ tím vào 3 mẫu thử thì chỉ có NH4Cl làm quỳ tím hóa đỏ. Do hiện tượng thủy phân của NH4Cl:
- Cho AgNO3 vào 2 dung dịch còn lại thì NaCl tạo kết tủa trắng.
AgNO3 + NaCl → AgCl↓ + NaNO3
Câu 9:
(1). NH4NO2
(2). KMnO4
(3). NH3 + O2
(4). NH4Cl
(5). (NH4)2CO3
(6). AgNO3
Số thí nghiệm tạo ra đơn chất là :
A. 6
B. 5
C. 4
D. 3
Đáp án: C
Giải thích:
Số thí nghiệm tạo ra đơn chất là (1), (2), (3) và (6).
(1).
(2).
(3).
(4).
(5).
(6).
Câu 10:
A. CO2
B. CO
C. HCl
D. Cl2
Đáp án: A
Giải thích:
Phân urê là (NH2)CO.
Điều chế:
CO2 + 2NH3 (NH2)2CO + H2O
Câu 11:
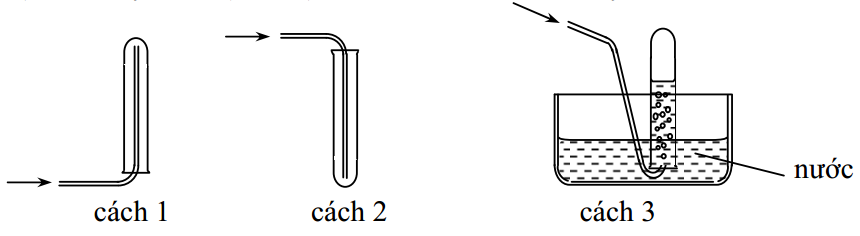
Có thể dùng cách nào trong 3 cách trên để thu khí NH3?
A. Cách 1
B. Cách 2
C. Cách 3
D. Cách 2 hoặc 3
Đáp án: A
Giải thích:
+ NH3 là chất khí tan rất nhiều trong nước nên ta loại cách 3.
+ NH3 nhẹ hơn không khí → Khi thu khí phải úp ống nghiệm.
→ Sử dụng cách 1 để thu khí NH3.
Câu 12: Cho 4 lít N2 và 14 lít H2 vào bình phản ứng ở điều kiện thích hợp, hỗn hợp thu được sau phản ứng có thể tích bằng 16,4 lít (thể tích các khí được đo ở cùng điều kiện). Hiệu suất phản ứng là
A. 30%.
B. 20%.
C. 17,14%.
D. 34,28%.
Đáp án: B
Giải thích:
N2 + 3H2 2NH3
Nhận thấy: → Hiệu suất tính theo N2.
Gọi phản ứng = a lít
→ phản ứng = 3a lít và lít
→
→ a = 0,8 lít
Câu 13:
A. muối hỗn tạp.
B. muối trung hòa.
C. muối axit.
D. muối kép.
Đáp án: C
Giải thích: Muối NH4HCO3 thuộc loại muối axit vì gốc vẫn có khả năng phân li ion H+
Câu 14:
A. NH4NO2 N2 + 2H2O
B. NH4NO3 NH3 + HNO3
C. NH4ClNH3 + HCl
D. NH4HCO3 NH3 + H2O + CO2
Đáp án: B
Giải thích:
NH4NO3 N2O + 2H2O
Câu 15:
A. HCl
B. H2SO4
C. CaO
D. HNO3
Đáp án: C
Giải thích:
Nguyên tắc chung cần ghi nhớ:
- Chất làm khô là chất có khả năng hút ẩm mạnh.
- Chất làm khô không tác dụng, không hòa tan với khí (cả khi có nước)
- Trong quá trình làm khô khí thì không giải phóng khí khác.
Nhận thấy, các axit HCl, H2SO4, HNO3 đều có phản ứng với NH3 ⇒ loại các đáp án A, B, D
Câu 16:
A. CuCl2
B. KNO3
C. NaCl
D. AlCl3
Đáp án: D
Giải thích:
- Các muối NaCl, KNO3 không phản ứng với NH3
- CuCl2 và AlCl3 tạo kết tủa với NH3:
CuCl2 + 2NH3 + 2H2O → Cu(OH)2↓ + 2NH4Cl
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Tuy nhiên, khi dùng NH3 dư thì hòa tan được kết tủa Cu(OH)2 tạo phức tan [Cu(NH3)4](OH)2.
→ Chỉ có AlCl3 tạo kết tủa với NH3 dư.
Câu 17:
A.
B.
C.
D.
Đáp án: D
Giải thích:
A sai vì NH4NO3N2O + 2H2O
B sai vì 4Fe(NO3)2 2Fe2O3 + 8NO2 + O2
C sai vì 2Cu(NO3)2 2CuO + 4NO2 + O2
D đúng.
Câu 18:
A. NaOH.
B.BaCl2.
C. NaHSO4.
D. Ba(OH)2.
Đáp án: D
Giải thích:
Cho lần lượt tới dư các thuốc thử vào các mẫu thử:
A.
- NH4NO3 và (NH4)2SO4: sủi bọt khí không màu, mùi khai.
- Al(NO3)3: kết tủa keo trắng rồi tan → chỉ nhận được Al(NO3)3 → loại.
B.
- NH4NO3 và Al(NO3)3: không hiện tượng.
(NH4)2SO4: kết tủa trắng → chỉ nhận được (NH4)2SO4 → loại.
C. Không mẫu thử nào có hiện tượng → loại.
D.
- NH4NO3: sủi bọt khí không màu, mùi khai.
- Al(NO3)3: kết tủa keo trắng rồi tan.
- (NH4)2SO4: kết tủa trắng không tan.
→ nhận được cả 3 dung dịch.
Câu 19:
A. Muối amoni kém bền với nhiệt.
B. Tất cả muối amoni tan trong nước.
C. Các muối amoni đều là chất điện li mạnh.
D. Dung dịch của các muối amoni luôn có môi trường bazơ.
Đáp án: D
Giải thích:
D sai do NH4+ + H2O ⇄ NH3 + H3O+
→ muối amoni thường có môi trường axit.
Câu 20:
A. 0,56 lít.
B. 11,20 lít.
C. 1,12 lít.
D. 5,60 lít.
Đáp án: D
Giải thích:
NH4NO2 N2 + 2H2O
lít
Câu 21:
A. Ca(OH)2.
B. MgCl2.
C. FeSO4.
D. NaOH.
Đáp án: D
Giải thích:
Ta có các phản ứng:
(NH4)2CO3 + Ca(OH)2 → CaCO3↓ + 2NH3↑ + 2H2O
(NH4)2CO3 + MgCl2 → MgCO3 + 2NH4Cl
(NH4)2CO3 + FeSO4 → FeCO3↓ + (NH4)2SO4
(NH4)2CO3 + 2NaOH → Na2CO3 + 2NH3↑ + 2H2O.
Câu 22:
A. 2,75 mol.
B. 3,50 mol.
C. 1,00 mol.
D. 2,50 mol.
Đáp án: A
Giải thích:
4NH3 + 5O2 4NO + 6H2O
phản ứng = 2.0,9 = 1,8 mol.
→ phản ứng =
→dư = 5 – 2,25 = 2,75 mol
Câu 23:
A. 5.
B. 3.
C. 2.
D. 4.
Đáp án: B
Giải thích:
NH3 chỉ khử được oxit của các kim loại sau Al.
→ NH3 chỉ phản ứng với FeO, CuO và PbO
2NH3 + 3FeO 3Fe + N2 + 3H2O
2NH3 +3CuO 3Cu + N2 + 3H2O
2NH3 +3PbO 3Pb + N2 + 3H2O
Câu 24:
A. Cl2.
B. O2.
C. HCl.
D. CuO.
Đáp án: C
Giải thích: NH3 + HCl → NH4Cl
Câu 25:
A. 22,4 lít.
B. 13,44 lít.
C. 8,96 lít.
D. 1,12 lít.
Đáp án: C
Giải thích:
NaNO2 + NH4Cl N2 + NaCl + 2H2O
→
→ lít
Câu 26:
A. NH4HSO3.
B. Na2SO3.
C. NH4HCO3.
D. (NH4)2CO3.
Đáp án: A
Giải thích:
- X+ NaOH sinh ra khí có mùi khai → cation là
- Dung dịch X không tạo kết tủa với dung dịch BaCl2 → gốc axit không thể là
- Dung dịch X + HCl sinh ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím → anion là
→ X là NH4HSO3.
Câu 27:
A. cho hỗn hợp qua nước vôi trong dư.
B. cho hỗn hợp qua bột CuO nung nóng.
C. nén và làm lạnh hỗn hợp để hóa lỏng NH3.
D. cho hỗn hợp qua dung dịch H2SO4 đặc.
Đáp án: C
Giải thích: Trong công nghiệp, để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 người đem nén và làm lạnh hỗn hợp khí thì chỉ có NH3 hóa lỏng và tách ra.
Câu 28:
A. trên N còn cặp electron tự do.
B. phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong nước.
D. NH3 tác dụng với nước tạo NH4OH.
Đáp án: A
Giải thích: Trong phân tử NH3, nguyên tử N còn có 1 cặp electron tự do → gây nên tính bazơ của NH3.
Câu 29:
A. 5,28 gam.
B. 6,60 gam.
C. 5,35 gam.
D. 6,35 gam.
Đáp án: D
Giải thích:
Bảo toàn điện tích ta có:
Bảo toàn khối lượng muối ta có:
mmuối = mcation + manion
→ mmuối = 0,1.18 + 0,04.96 + 0,02.35,5 = 6,35 gam
Câu 30:
A. 1,12.
B. 2,24.
C. 3,36.
D. 10,08.
Đáp án: C
Giải thích:
2Na + 2H2O → 2NaOH + H2
2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
→ Khí thu được gồm H2 và NH3
→ nNaOH = 0,1 mol < 0,2
→ lít
lít
→ V = 2,24 + 1,12 = 3,36 lít.
Bài 31: X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3.
B. (NH4)2SO3.
C. NH4HSO3.
D. (NH4)3PO4.
Đáp án: C
Bài 32: Nhận xét nào sau đây không đúng về muối amoni ?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. các muối amoni đều bị thủy phân trong nước.
Đáp án: A
Bài 33: Oxi hóa 6 lít NH3 (tạo ra N2 và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí ( chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
A. 6,5.
B. 22,5.
C. 32,5.
D. 24,5.
Đáp án: C
Bài 34: Cho 22,4 lít hỗn hợp khi X gồm N2 và H2 đi qua xúc tác Fe, nung nống để tổng hợp NH3 thu được 20,16 lít hỗn hợp khí Y. Hấp thụ toàn bộ Y vào dung dịch AlCl3 dư, thu được m gam kết tủa. Các thể tích khí đó ở cùng điều kiện. Giá trị của m là
A. 13.
B. 2,6.
C. 5,2.
D. 3,9.
Đáp án: B
Bài 35: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu(trong cùng điều kiện). HIệu suất phản ứng là
A. 20%.
B. 22,5%.
C. 25%.
D. 27%.
Đáp án: B
Bài 36: Điều chế NH3 từ hỗn hợp hồm N2 và H2 (tỉ lệ 1 : 3) . Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là
A. 25%.
B. 40%.
C. 10%.
D. 20%.
Đáp án: D
Bài 37: Hỗn hợp X gồm NH4Cl và (NH4)2SO4. Cho X tác dụng với dung dịch Ba(OH)2 dư, đun nhẹ thu được 9,32 gam kết tủa và 2,24 lít khí thoát ra. Hỗn hợp X có khối lượng là
A. 5,28 gam.
B. 6,60 gam.
C. 5,35 gam.
D. 6,35 gam.
Đáp án: D
Bài 38: Cho 14,8 gam Ca(OH)2 vào 150 gam dung dịch (NH4)2SO4 26,4% rồi đun nóng thu được V lít khí (đktc). Để đốt cháy hết V lít khí trên cần vừa đủ một lượng O2. Lượng O2 trên thu được khi nung m gam KClO2 (có xúc tác). Giá trị của m là
A. 73,5.
B. 49.
C. 24,5.
D. 12,25.
Đáp án: C
Bài 39: Trộn 300 ml dung dịch NaNO2 2M với 200 ml dung dịch NH4Cl 2M rồi đun nóng cho đến khi phản ứng xảy ra hoàn toàn. Thể tích khí thu được ở đktc là
A. 22,4 lít.
B. 13,44 lít.
C. 8,96 lít.
D. 1,12 lít.
Đáp án: C
Bài 40: Cho 100 gam dung dịch NH4HSO4 11,5% vào 100 gam dung dịch Ba(OH)2 13,68% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
A. 2,24 lít và 23,3 gam
B. 2,244 lít và 18,64 gam
C. 1,344 lít và 18,64 gam
D. 1,792 lít và 18,64 gam.
Đáp án: C
Các câu hỏi trắc nghiệm Hóa lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Axit nitric và muối nitrat có đáp án
Trắc nghiệm Axit photphoric và muối photphat có đáp án
Trắc nghiệm Phân bón hóa học có đáp án
Trắc nghiệm Luyện tập: Tính chất hóa học của nitơ, photpho và hợp chất của chúng có đáp án