Anonymous
0
0
Sách bài tập Hóa 11 Bài 3 (Chân trời sáng tạo): Đơn chất nitrogen
- asked 6 months agoVotes
0Answers
0Views
Giải SBT Hóa 11 Bài 3: Đơn chất nitrogen
Bài 3.1 trang 16 SBT Hóa học 11: Ở trạng thái tự nhiên, nitrogen
A. tồn tại ở dạng đơn chất và hợp chất.
B. chỉ tồn tại ở dạng đơn chất.
C. chỉ tồn tại ở dạng hợp chất.
D. tự do chiếm khoảng 20% thể tích không khí.
Lời giải:
Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
→ Chọn A.
Bài 3.2 trang 16 SBT Hóa học 11: Cấu hình electron nguyên tử của nitrogen là
B. 1s22s22p5.
C. 1s22s22p4.
D. 1s22s22p3.
Lời giải:
N (Z = 7): 1s22s22p3
→ Chọn D.
Bài 3.3 trang 16 SBT Hóa học 11: Tính chất nào sau đây của nitrogen không đúng?
A. Ở điều kiện thường, nitrogen là chất khí.
B. Nitrogen tan rất ít trong nước.
C. Nitrogen không duy trì sự cháy và sự hô hấp.
D. Nitrogen nặng hơn không khí.
Lời giải:
→ Chọn D.
Bài 3.4 trang 16 SBT Hóa học 11: Nitrogen trong không khí có vai trò nào sau đây?
A. Cung cấp đạm tự nhiên cho cây trồng.
B. Hình thành sấm sét.
C. Tham gia quá trình quang hợp của cây.
D. Tham gia hình thành mây.
Lời giải:
Trong không khí, nitrogen cung cấp đạm tự nhiên cho cây trồng.
→ Chọn A.
Bài 3.5 trang 16 SBT Hóa học 11: a) Tại sao nitrogen là phi kim mạnh lại tồn tại được trong tự nhiên dưới dạng tự do?
Lời giải:
a) Nitrogen là phi kim mạnh, nhưng đơn chất nitrogen hoạt động hoá học kém ở nhiệt độ thường, tồn tại được trong tự nhiên (khí quyển) vì phân tử N2 có liên kết ba (N≡N) rất bền, không thể phân huỷ thành nguyên tử khi ở nhiệt độ thấp hoặc không có xúc tác.
Ví dụ:Ca3N2 +6H2O → 2NH3 + 3Ca(OH)2
Vì lí do trên nên vỏ Trái Đất không tồn tại các hợp chất nitride kim loại.
Bài 3.6 trang 17 SBT Hóa học 11: Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.
Lời giải:
Bài 3.7 trang 17 SBT Hóa học 11: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Lời giải:
Ban đầu (mol): 0,5 1,5 0
Phản ứng (mol): 0,1 ← 0,3 ← 0,2
Cân bằng (mol): 0,4 1,2 0,2
Bài 3.8 trang 17 SBT Hóa học 11: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
Lời giải:
+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
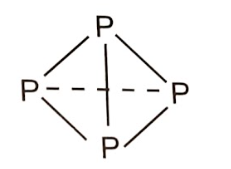
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
Bài 3.9 trang 17 SBT Hóa học 11: Xác định cụm từ phù hợp trong các ô từ (1) đến (7) để hoàn thành chu trình của nitrogen trong tự nhiên.
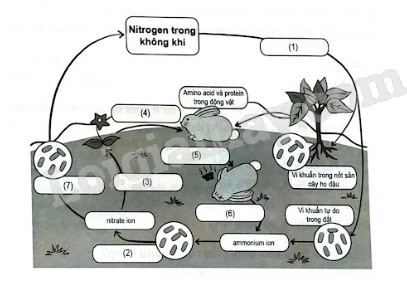
Lời giải:
(1) Quá trình cố định đạm.
(2) Quá trình nitrate hóa bởi vi khuẩn.
(3) Quá trình hấp thu đạm của rễ cây.
(4) Động vật sử dụng thức ăn là thực vật.
(5) Động vật chết.
(6) Quá trình phân hủy xác động vật.
(7) Quá trình khử nitrogen.