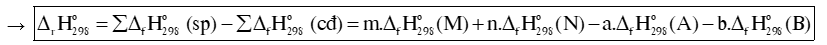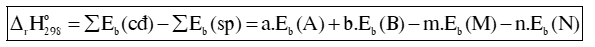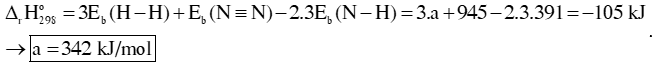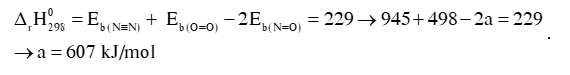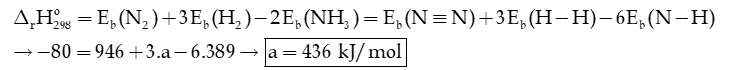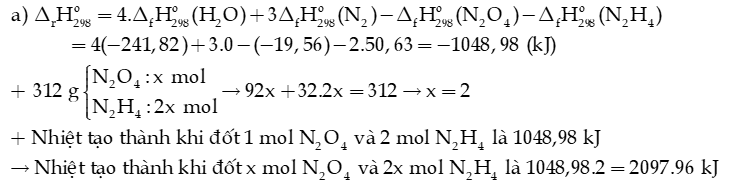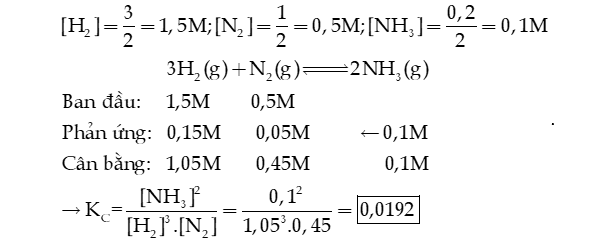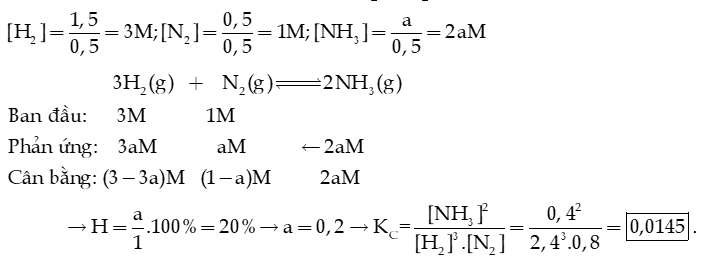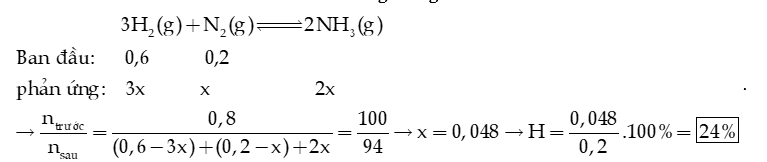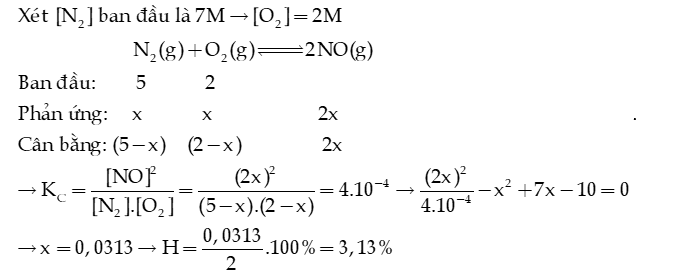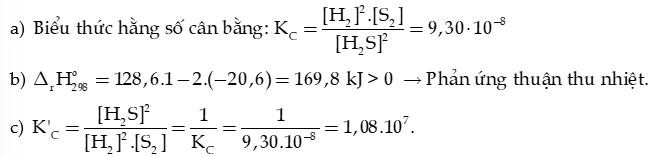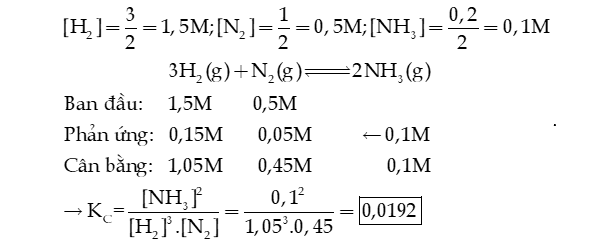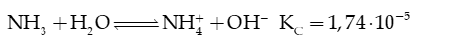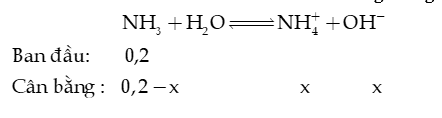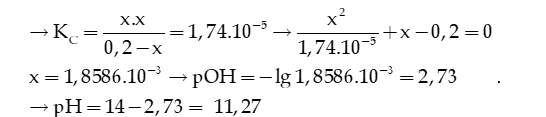Anonymous
0
0
Ôn tập Nitrogen và hợp chất của nitrogen | Chuyên đề dạy thêm Hoá học 11
- asked 6 months agoVotes
0Answers
0Views
A. CÁC DẠNG CÂU HỎI TỰ LUẬN
DẠNG 1: BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG
Cho phản ứng: aA + bB mM + nN
Biến thiên enthalpy chuẩn của phản ứng, tính theo nhiệt tạo thành :
Biến thiên enthalpy chuẩn của phản ứng, tính theo năng lượng liên kết:
Trong đó: Eb (A), Eb (B), Eb (M), Eb (N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong phân tử A, B, M, N.
Câu 1: Cho phản ứng: 3H2 (g) + N2 (g)⇌ 2NH3. Biến thiên enthalpy của phản ứng tạo thành ammonia (NH3) ở 298K là -105 kJ, cho biết năng lượng liên kết Eb (N≡N) = 945 kJ/mol; Eb (N – H) = 391 kJ/mol, biến thiên enthalpy của phản ứn ở 298K là -105 kJ.
a) Cho biết phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt.
b) Tính năng lượng liên kết Eb (H – H).
Hướng dẫn giải:
a) Ta thấy = -105kJ < 0 → Phản ứng tỏa nhiệt.
b) Biến thiên enthalpy của phản ứng tạo thành ammonia (NH3):
Câu 2: Cho cân bằng hoá học sau:
a) Hãy tính của phản ứng, cho nhiệt tạo thành của NO2 (g) và N2O4 (g) lần lượt là 33,2 kJ/mol và 11,1 kJ/mol.
b) Cân bằng sẽ chuyển dịch theo chiều nào khi giảm nhiệt độ của hệ?
Hướng dẫn giải:
a) =11,1-2.33,2 = -55,3 kJ/mol
b) Phản ứng trên là phản ứng tỏa nhiệt, khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận.
Câu 3: Dựa vào năng lượng liên kết ở bảng:
Liên kết |
N≡N |
O = O |
N = O |
Eb (kJ/mol) |
945 |
498 |
a |
Biến thiên enthalpy của phản ứng là 229 kJ.
N2(g) + O2(g) 2NO(g)
Hướng dẫn giải:
N2 (g) + O2 (g) 2NO (g)
Câu 4: Cho phản ứng sau:
Hãy xác định:
a) Biến thiên enthalpy của phản ứng, cho nhiệt tạo thành chuẩn của S8 (g) và H2S (g) lần lượt là 101,3 kJ/mol -20,6 kJ/mol.
b) Năng lượng liên kết trong phân tử S8 (g), biết và .
Hướng dẫn giải:
a) =-20,6 - 101,3 = -33,2625 kJ
b)
Câu 5: Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
|
Liên kết |
H – H |
N – H |
N ≡ N |
|
Năng lượng liên kết (kJ/mol) |
a |
389 |
946 |
Biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết là -80 kJ.
Tính a.
Hướng dẫn giải:
Câu 6: Cho phương trình hóa học của phản ứng:
Biết enthalpy tạo thành chuẩn của các chất được trình bày trong bảng sau:
a) Tính nhiệt đốt cháy 312 gam hỗn hợp lỏng gồm N2O4 và N2H4.
b) Tại sao hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa?
Hướng dẫn giải:
b) Hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa vì khi xảy ra phản ứng nó tỏa ra lượng nhiệt rất lớn.
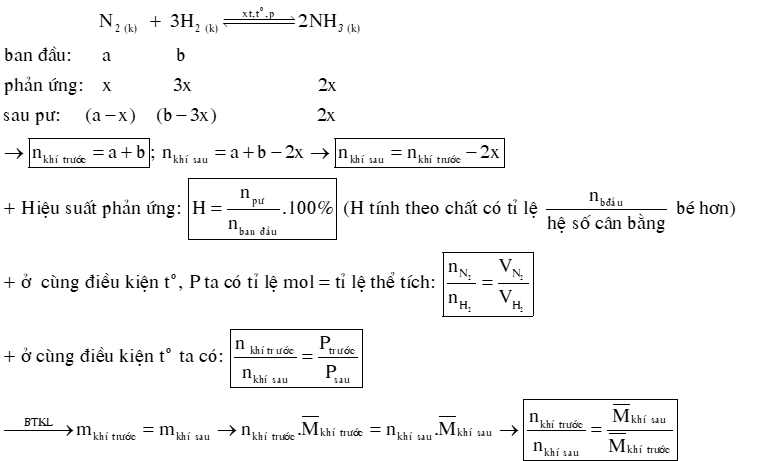
DẠNG 2: HẰNG SỐ CÂN BẰNG, HIỆU SUẤT PHẢN ỨNG.
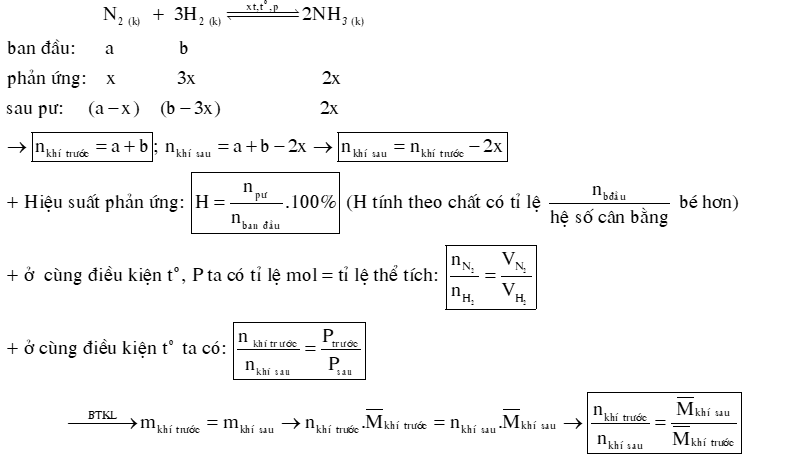
1) Hằng số cân bằng của phản ứng: aA + bB ⇌ cC + dD
2) Hiệu suất của phản ứng tổng hợp NH3.
Câu 7: Một bình kín có dung tích là 2 L chứa 3 mol H2 và 1 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Hướng dẫn giải:
Câu 8: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng, hiệu suất phản ứng là 20%, có a mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Hướng dẫn giải:
Câu 9: Cho 0,8 mol hỗn hợp X gồm 0,2 mol và 0,6 mol . Nung nóng X trong bình kín (450oC, xúc tác ) một thời gian, thu được hỗn hợp khí có số mol giảm 6% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
Hướng dẫn giải:
Câu 10: Cho cân bằng ở 1650oC: . Thực hiện phản ứng trên với một hỗn hợp nitrogen và oxygen có tỉ lệ mol tương ứng là 5 : 2. Tính hiệu suất của phản ứng khi hệ cân bằng ở 1650oC.
Hướng dẫn giải:
Câu 11: Hydrogen sulfide phân huỷ theo phản ứng sau đây:
Hằng số cân bằng ở 427oC .
a) Viết biểu thức hằng số cân bằng của phản ứng.
b) Xác định biến thiên enthalpy chuẩn của phản ứng, biết nhiệt tạo thành chuẩn của và lần lượt là -20,6 kJ/mol và 128,6 kJ/mol. Cho biết phản ứng thuận là toả nhiệt hay thu nhiệt.
c) Ở 427oC, tính hằng số cân bằng của phản ứng:
Hướng dẫn giải:
DẠNG 2: HẰNG SỐ CÂN BẰNG, HIỆU SUẤT PHẢN ỨNG
1) Hằng số cân bằng của phản ứng: aA + bB ⇌ cC + dD
Lưu ý: Không biểu diễn nồng độ chất rắn, nước (lỏng) trong biểu thức hằng số cân bằng.
2) Hiệu suất của phản ứng tổng hợp NH3.
Câu 12: Một bình kín có dung tích là 2 L chứa 3 mol H2 và 1 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Hướng dẫn giải:
Câu 13: Xét cân bằng của dung dịch :
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Hướng dẫn giải:
Chủ đề 5: Sulfur và Sulfur dioxide
Chủ đề 6: Sulfuric acid và muối Sulfate
Chủ đề 7: Một số dạng bài tập về Sulfuric acid loãng