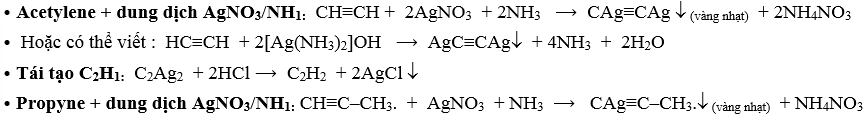Anonymous
0
0
Chủ đề 2: Hydrocarbon không no | Chuyên đề dạy thêm Hoá học 11
- asked 6 months agoVotes
0Answers
0Views
A. PHẦN LÝ THUYẾT
I. KHÁI NIỆM
II. ĐỒNG PHÂN – DANH PHÁP
2.1. Đồng phân cấu tạo
- Các alkene và alkyne C2, C3 không có đồng phân. Từ C4 trở đi có đồng phân mạch C & đồng phân vị trí liên kết bội.
- Cách viết đồng phân của alkene và alkyne :
+ Bước 1 : Viết mạch carbon không phân nhánh. Sau đó, đặt liên kết bội vào các vị trí khác nhau trên mạch chính.
+ Bước 2 : Viết mạch carbon phân nhánh :
⦁ Bẻ 1 carbon làm nhánh, đặt nhánh vào các vị trí khác nhau trong mạch. Sau đó ứng với mỗi mạch carbon lại đặt liên
kết bội vào các vị trí khác nhau.
⦁ Khi bẻ 1 carbon không còn đồng phân thì bẻ đến 2 carbon. 2 carbon có thể cùng liên kết với 1C hoặc 2C khác nhau. Lại đặt liên kết bội vào các vị trí khác nhau.
⦁ Lần lượt bẻ tiếp các nguyên tử carbon khác cho đến khi không bẻ được nữa thì dừng lại.
2.2. Đồng phân hình học : Là đồng phân về vị trí không gian của hợp chất có liên kết đôi C=C.
2.3. Tên IUPAC = Tên thay thế = Tên quốc tế = Tên hệ thống của alkene – alkyne
Bước Nhiệm vụ thực hiện
Bước |
Nhiệm vụ thực hiện |
1 |
Chọn mạch carbon chính phải dài nhất (nhiều C nhất). |
2 |
Đánh số thứ tự carbon gần vị trí liên kết bội nhất sao cho tổng số vị trí nhánh là nhỏ nhất. |
3 |
Phải nêu đầy đủ số chỉ vị trí của các nhánh và thêm tiền tố di (2), tri (3), tetra (4) trước tên các nhánh giống nhau. |
4 |
Giữa số và số phải có dấu phẩy. Giữa số và chữ phải có dấu gạch ngang “–“ |
5 |
Nhóm thế cùng loại : Thứ tự đọc theo α, b, …. Ví dụ trong phân tử có nhóm -CH3- và -C2H5 thì đọc ethyl trước và methyl sau. |
|
Nhóm thế khác loại : –Halogen ⟶ Nitro (–NO2) ⟶ –Alkyl | |
6 |
Tên Alkene = số chỉ vị trí nhánh + tên nhánh + tên mạch chính + vị trí liên kết đôi + ene |
|
Tên Alkyne = số chỉ vị trí nhánh + tên nhánh + tên mạch chính + vị trí liên kết ba + yne |
2.4. Tên các nhóm alkenyl : Alkene (CnH2n) Alkenyl (–CnH2n-1)
2.5. Tên thông thường : Một số ít alkene và alkyne có tên thông thường :
⦁ Ví dụ 1: C2H4 : CH2=CH2 : Ethene hay Ethylene
C3H6 : CH2=CH-CH2 : Propene hay Propylene
C2H2 : CH≡CH : Ethyne hay Acetylene
C4H6 : CH2=CH-CH=CH2 : Divinyl
C4H4 : CH2=CH-C≡CH : Vinyl acetylene
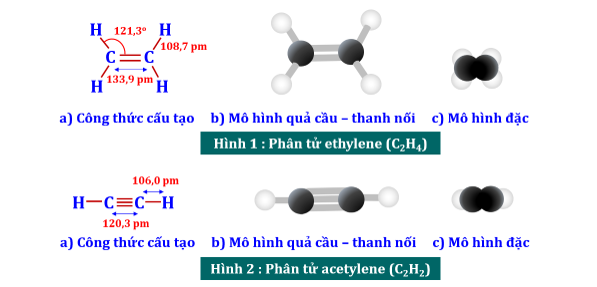
III. CẤU TẠO CỦA ETHYLENE & ACETYLENE
+ Phân tử ethylene (C2H4) có :
⦁ 2C và 4H đều nằm trên một mặt phẳng.
⦁ Các góc liên kết . Liên kết đôi C=C gồm 1 liên kết + 1 liên kết π.
+ Phân tử acetylene (C2H2) có :
⦁ 2C và 2H đều nằm trên một đường thẳng.
⦁ Góc liên kết . Liên kết ba C≡C gồm 1 liên kết + 2 liên kết π.
+ Nhận xét : Liên kết π kém bền hơn liên kết nên dễ bị phá vỡ khi tham gia phản ứng.
IV. TÍNH CHẤT VẬT LÍ
+ Các alkane, alkyne thường không màu, không mùi, nhẹ hơn nước & ít tan trong nước, nhưng tan trong một số dung môi hữu cơ.
+ Trạng thái của alkene & alkyne :
⦁ C2 ⟶ C4 : Trạng thái khí.
⦁ C5 ⟶ C17 : Trạng thái lỏng.
⦁ Từ C18 trở đi : Trạng thái rắn.
So sánh nhiệt độ sôi, nhiệt độ nóng chảy :
⦁ Các alkene, alkyne có tos, tonc tăng dần khi số C tăng dần (do khối lượng phân tử & lực tương tác Van Der Waals đều tăng dần).
⦁ Đồng phân hình học cis– & trans– : tonc (cis–) < tonc (trans–) (do đồng phân trans- dạng đối xứng ⟶ tinh thể chặt chẽ).
⦁ Còn tos (cis–) < tos (trans–) (do đồng phân trans có tổng moment lưỡng cược thường triệt tiêu hoặc gần triệt tiêu, còn đồng phân cis có tổng moment lưỡng cực không triệt tiêu)
⦁ Các alkane, alkene, alkyne có tos, tonc sấp xỉ nhau. Tuy nhiên khi cùng mạch C : Alkene < Alkane < Alkyne. Ví dụ : C3H6 < C3H8 < C3H4.
V. TÍNH CHẤT HOÁ HỌC
Nhận xét chung: Do trong phân tử alkene và alkyne có liên kết bội gồm liên kết và liên kết π, trong đó liên kết π kém bền hơn nên dễ bị phá vỡ khi tham gia phản ứng. Vì vậy hydrocarbon không no có k liên kết π thì có thể cộng hợp tối đa k phân tử X2 (thường là H2, Br2) vào liên kết bội. Trong các phản ứng này, liên kết bội chuyển thành liên kết đơn C–C.
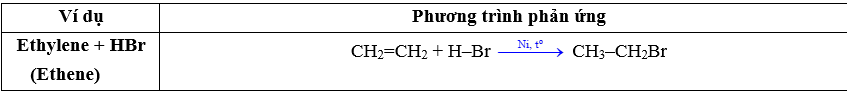
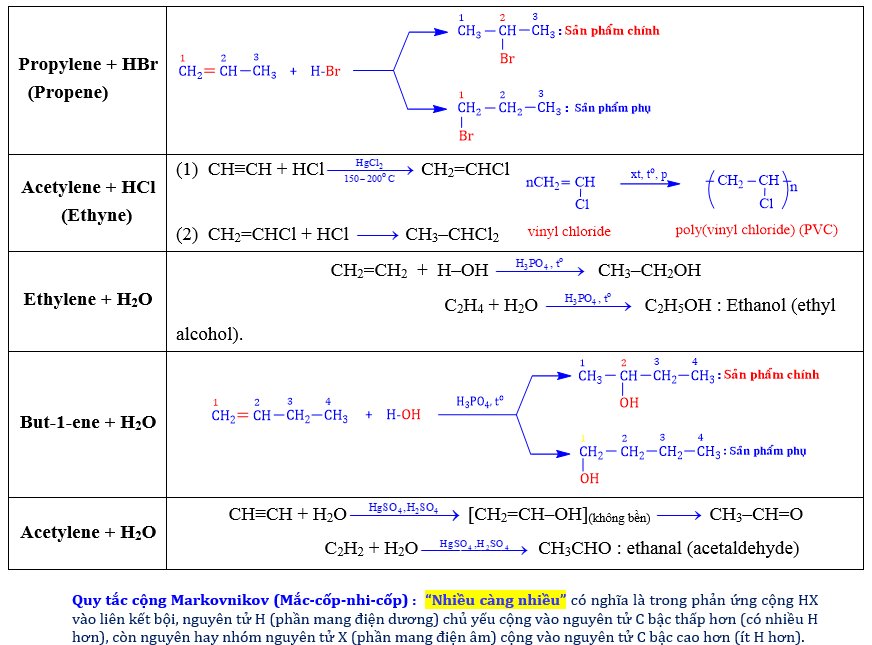
5.1. Phản ứng cộng : Phản ứng đặc trưng của hydrocarbon không no :
a) Cộng X1: H2 (hydrogen hóa), Br2, (bromine hóa),… : Tác nhân đối xứng : X–X
b) Cộng HX : HBr, HCl, H2O (hydrate hóa),… : Tác nhân bất đối xứng : H–X
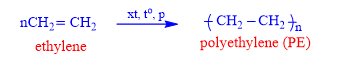
5.2. Phản ứng trùng hợp
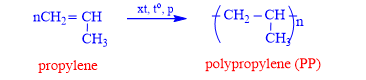
a. Nhựa PE : Trùng hợp ethylene
b. Nhựa PP : Trùng hợp propylene
⟶ PP dùng àm bao bì đựng lương thực, chai đựng nước,…
⦁ Với n được gọi là hệ số trùng hợp.
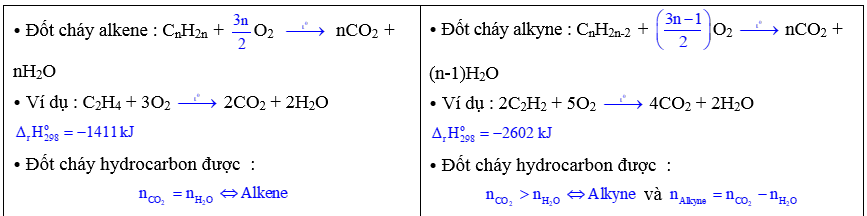
5.3. Phản ứng oxi hóa
a. Phản ứng oxi hóa không hoàn toàn :
⦁ Dẫn khí C2H4 vào dung dịch KMnO4 (màu tím) thấy dung dịch mất màu tím & xuất hiện kết tủa đen :
3CH2=CH2 + 2KMnO4 + 4H2O ⟶ 3HOCH2-CH2OH + 2MnO2 ↓(đen) + 2KOH
ethylene ethylene glycol
⟶ Hydrocarbon không no, mạch hở, chứa lên kết bội làm mất màu dung dịch thuốc tím KMnO4.
b. Phản ứng cháy (oxi hóa hoàn toàn)
5.4. Phản ứng thế nguyên tử H linh động của alkyne có nối ba đầu mạch : Alk-1-yne + AgNO3/NH3
⦁ But-2-yne + dung dịch AgNO3/NH3 : CH3-C≡C-CH3 + AgNO3 + NH3 : Không xảy ra vì không có H linh động.
⟶ Phản ứng này dùng các alkyne liên kết ≡ đầu mạch (Alk-1-yne) với : Alkane, alkene, alkyne không có liên kết ≡ đầu mạch.
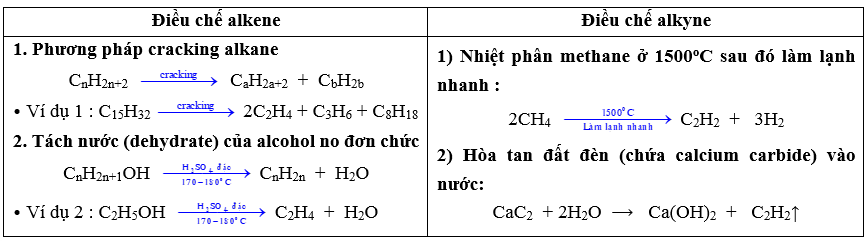
VI. ĐIỀU CHẾ, ỨNG DỤNG
Ứng dụng của alkene & alkyne | ||
|
Khí acetylene cháy tỏa nhiều nhiệt nên được ứng dụng dùng trong đèn xì acetylen – oxygen và được sử dụng để hàn, cắt kim loại. | ||