Anonymous
0
0
Lý thuyết Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học - Cánh diều
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
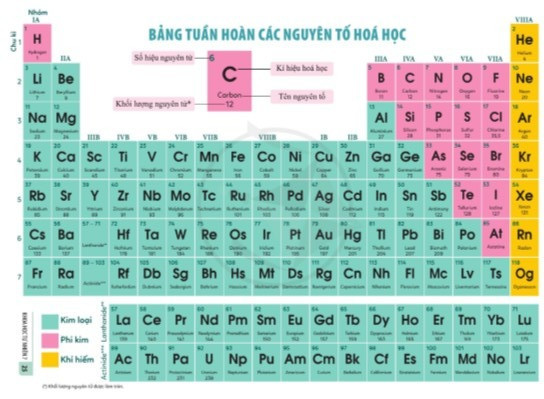
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được xếp theo quy luật trong một bảng, gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn).
- Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học và được xếp theo nguyên tắc sau:
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau.
II. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột.
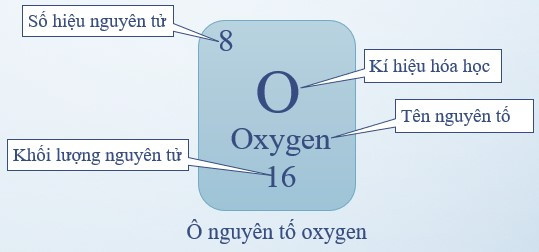
1. Ô nguyên tố
- Ô nguyên tố: là một ô trong bảng tuần hoàn tương ứng với một nguyên tố hóa học.
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (kí hiệu là Z): bằng số đơn vị điện tích hạt nhân (bằng số proton và bằng số electron) và là số thứ tự của nguyên tố
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
Ví dụ: Ô nguyên tố oxygen
2. Chu kì
- Chu kì gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự của chu kì = số lớp electron của nguyên tố
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ chu kì 1 đến chu kì 7.
- Trong một chu kì, khi đi từ trái qua phải theo chiều tăng dần của điện tích hạt nhân:
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1).
+ Cuối chu kì là một phi kim điển hình (trừ chu kì 7).
+ Kết thúc chu kì là một khí hiếm.
- Ví dụ: Trong chu kì 4:
+ Mở đầu chu kì là nguyên tố potassium (K) – là một kim loại điển hình
+ Cuối chu kì là nguyên tố bromine (Br) – là một phi kim điển hình
+ Kết thúc chu kì là nguyên tố krypton (Kr) – là một khí hiếm
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Bảng tuần hoàn gồm 18 cột gồm:
+ 8 cột là nhóm A.
+ 10 cột là nhóm B: gọi kà nhóm các nguyên tố kim loại chuyển tiếp (trong phạm vi chương trình chỉ nghiên cứu 8 nhóm A).
- Nhóm A được đánh số bằng số La Mã lần lượt từ nhóm IA đến VIIIA.
- Số thứ tự của nhóm A=số electron lớp ngoài cùng.
Ví dụ:
+ Nhóm IA: gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H); đều có 1 electron ở lớp ngoài cùng.
+ Nhóm VIIA: gồm các nguyên tố phi kim hoạt động mạnh (phi kim điển hình), trừ tennessine (Ts); đều có 7 electron ở lớp ngoài cùng.
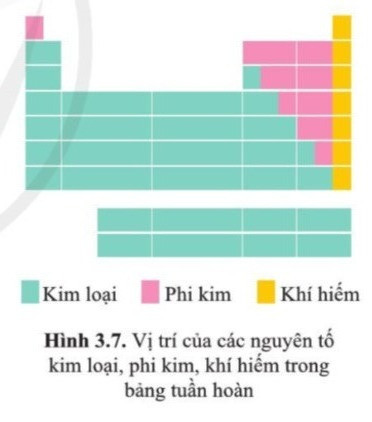
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn.
- Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên.
- Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.
IV. Ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn cho biết:
- Các thông tin của một nguyên tố hóa học: tên nguyên tố, số hiệu nguyên tử, kí hiệu hóa học, khối lượng nguyên tử.
- Vị trí của nguyên tố hóa học (ô, chu kì, nhóm). Từ đó nhận ra được các nguyên tố kim loại, phi kim hay khí hiếm:
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố nhóm VIIIA là khí hiếm.