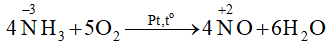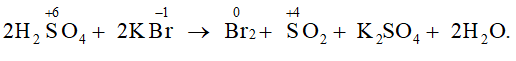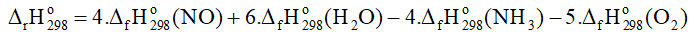Anonymous
0
0
Giải Hóa 11 Bài 9 (Kết nối tri thức): Ôn tập chương 2
- asked 6 months agoVotes
0Answers
0Views
Giải Hóa 11 Bài 9: Ôn tập chương 2
Giải Hóa 11 trang 56
Câu hỏi 1 trang 56 Hóa học 11:Phân tử nitrogen có cấu tạo là
A. N = N. B. N ≡ N.
C. N – N. D. N → N.
Lời giải:
Phân tử nitrogen có cấu tạo là N ≡ N.
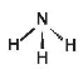
Câu hỏi 2 trang 56 Hóa học 11:Phân tử ammonia có dạng hình học nào sau đây?
Lời giải:
Phân tử ammonia có dạng hình học chóp tam giác.
Câu hỏi 3 trang 56 Hóa học 11: Ammonia đóng vai trò là chất khử khi tác dụng với chất nào sau đây?
A. H2O. B. HCl.
C. H3PO4. D. O2 (Pt, to).
Lời giải:
Ammonia đóng vai trò là chất khử khi tác dụng với O2(Pt, to).
Câu hỏi 4 trang 56 Hóa học 11: Khi so sánh phân tử ammonia với ion ammonium, nhận định nào sau đây là đúng?
B. Đều có tính acid yếu trong nước.
C. Đều có tính base yếu trong nước.
D. Đều chứa nguyên tử N có số oxi hoá là -3.
Lời giải:
Trong NH3và NH4+, nguyên tử N đều có số oxi hoá là -3.
Câu hỏi 5 trang 56 Hóa học 11:Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng?
A. NaCl. B. Na2SO4.
C. NaNO3. D. NaOH.
Lời giải:
BaCl2+ Na2SO4 → BaSO4+ 2NaCl.
BaSO4là chất kết tủa, có màu trắng.
Câu hỏi 6 trang 56 Hóa học 11:Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá – khử?
A. KBr. B. NaCl.
C. CaF2. D. CaCO3.
Lời giải:
Đáp án đúng là: A
Câu hỏi 7 trang 56 Hóa học 11:Khi pha loãng dung dịch sulfuric acid đặc cần tuân thủ thao tác nào sau đây để đảm bảo an toàn?
Lời giải:
Đáp án đúng là: A
Khi pha loãng dung dịch sulfuric acid đặc, để đảm bảo an toàn phảirót từ từ dung dịch sulfuric acid đặc vào nước, vừa rót vừa khuấy (không làm ngược lại).
Câu hỏi 8 trang 56 Hóa học 11:Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
4NH3(g) + 5O2(g)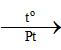
b) Tính năng lượng liên kết trong phân tử NO.
Biết năng lượng liên kết N – H, O = O, O – H lần lượt là 386 kJ/mol, 494 kJ/mol và 459 kJ/mol.
Lời giải:
a)
= 4. 90,3 + 6.(-241,8) – 4. (-45,9) = -906 kJ.
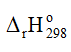
Phản ứng toả nhiệt này cần phải khơi mào, do đó có thể tận dụng nhiệt lượng toả ra này để tiếp diễn phản ứng mà không cần đốt nóng liên tục.
b)
⇒ -906 = 4. 3. 386 + 5.494 – 4. ENO – 6.2. 459
⇒ ENO = 625 kJ/mol.
Bài 10: Hợp chất hữu cơ và hoá học hữu cơ
Bài 11: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Bài 12: Công thức phân tử hợp chất hữu cơ