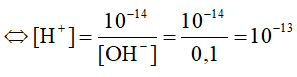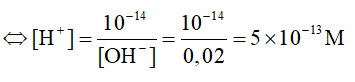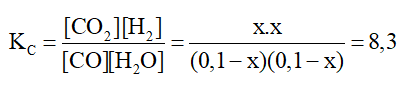Anonymous
0
0
Giải Hóa 11 Bài 3 (Kết nối tri thức): Ôn tập chương 1
- asked 6 months agoVotes
0Answers
0Views
Giải Hóa 11 Bài 3: Ôn tập chương 1
Bài giảng Bài 3: Ôn tập chương 1 - Kết nối tri thức
Giải Hóa 11 trang 28
Câu hỏi 1 trang 28 Hóa học 11: Hằng số KC của một phản ứng phụ thuộc vào yếu tố nào sau đây?
Lời giải:
Đáp án đúng là: B
Hằng số KC của một phản ứng phụ thuộc vào nhiệt độ.
Câu hỏi 2 trang 28 Hóa học 11:Thêm nước vào 10 mL dung dịch HCl 1,0 mol/L để được 1 000 mL dung dịch A. Dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
Lời giải:
Đáp án đúng là: D
Pha loãng dung dịch 100 lần thì nồng độ giảm 100 lần ⇒ pH tăng 2 đơn vị.
Câu hỏi 3 trang 28 Hóa học 11:Tính pH của các dung dịch sau:
Lời giải:
a) NaOH → Na+ + OH-
0,1 → 0,1 M
Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 13.
b) HCl → H+ + Cl-
0,1 → 0,1 M
Ta có: pH = -log[H+] = 1 M.
c) Ca(OH)2 → Ca2+ + 2OH-
0,01 → 0,02 M
Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 12,3.
Câu hỏi 4 trang 28 Hóa học 11:Viết biểu thức hằng số cân bằng KC cho các phản ứng sau:
c) AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
Lời giải:
a) 2SO2(g) + O2(g) ⇌ 2SO3 (g)
b) 2C(s) + O2(g) ⇌ 2CO(g)
c) AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
KC = [Ag+].[Cl-]
Câu hỏi 5 trang 28 Hóa học 11:Cho cân bằng hoá học sau:
H2(g) + I2(g) ⇌ 2HI(g) 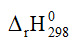
Nhận xét nào sau đây không đúng?
A. Khi tăng nhiệt độ, cân bằng trên chuyển dịch theo chiều nghịch.
B. Ở nhiệt độ không đổi, khi tăng áp suất thì cân bằng không bị chuyển dịch.
C. Ở nhiệt độ không đổi, khi tăng nồng độ H2 hoặc I2 thì giá trị hằng số cân bằng tăng.
D. Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Lời giải:
Đáp án đúng là: C
Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng, không phụ thuộc vào nồng độ.
Câu hỏi 6 trang 28 Hóa học 11:Xét phản ứng xảy ra trong lò luyện gang:
Fe2O3 (s) + 3CO(g) ⇌ 2Fe(s) + 3CO2(g) ∆rHo < 0
Lời giải:
- Tăng nồng độ CO, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ CO, tức chiều thuận, chiều tăng hiệu suất phản ứng.
- ∆rHo < 0 ⇒ Chiều thuận toả nhiệt ⇒ Giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm tăng nhiệt độ tức chiều thuận, chiều tăng hiệu suất phản ứng.
- Do phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế bằng nhau, việc thay đổi áp suất không làm ảnh hưởng đến cân bằng.
Câu hỏi 7 trang 28 Hóa học 11:Cho cân bằng hoá học sau:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Lời giải:
Nồng độ ban đầu của khí CO là:
Nồng độ ban đầu của hơi nước H2O là:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Ban đầu: 0,1 0,1 0 0 M
Phản ứng: x x x x M
Cân bằng: (0,1 – x) (0,1 – x) x x M
Áp dụng công thức:
⇒ x2 = 8,3(x2 – 0,2x + 0,01)
⇔ 7,3x2 – 1,66x + 0,083 = 0
⇒ x = 0,074 (thoả mãn); x = 0,153 (loại do > 0,1).
Vậy ở trạng thái cân bằng:
[CO2] = [H2] = 0,074 M.
[CO] = [H2O] = 0,026 M.
Bài 6: Một số hợp chất của nitrogen với oxygen