Anonymous
0
0
Các dạng bài toán tính tốc độ trung bình của phản ứng hóa học | Lý thuyết, công thức, các dạng bài tập và cách giải
- asked 6 months agoVotes
0Answers
0Views
Các dạng bài toán tính tốc độ trung bình của phản ứng hóa học
A. Lý thuyết và phương pháp giải
- Tốc độ phản ứng thường được xác định bằng độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
* Tính tốc độ phản ứng theo sự biến thiên nồng độ của một chất.
Xét phản ứng: A → B
+ Tốc độ phản ứng tính theo chất A trong khoảng thời gian từ t1đến t2được xác định như sau:
Trong đó:
Ở thời điểm t1, nồng độ chất A là C1(mol/l);
Ở thời điểm t2, nồng độ chất A là C2(mol/l)
+ Nếu tốc độ được tính theo sản phẩm B thì
Trong đó:
Ở thời điểm t1, nồng độ chất B là (mol/l)
Ở thời điểm t2, nồng độ chất B là (mol/l).
* Tính tốc độ phản ứng theo hằng số tốc độ phản ứng
Xét phản ứng: xA + yB → sản phẩm
Tốc độ phản ứng là:
Trong đó:
k: là hằng số tốc độ phản ứng
[A], [B] là nồng độ mol của chất A, B
x, y là hệ số phương trình của A, B
B. Ví dụ minh họa
Bài 1:Thực hiện phản ứng sau trong bình kín:
Lúc đầu nồng độ hơi Br2là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2trong khoảng thời gian trên là
A. mol/(l.s) .
B. mol/(l.s) .
C. mol/(l.s) .
D. mol/(l.s) .
Hướng dẫn giải:
Tốc độ trung bình của phản ứng tính theo Br2trong khoảng thời gian trên là:
mol/(l.s)
Đáp án C
Bài 2:Cho phản ứng hóa học: H2(k) + I2(k) 2HI(k)
Công thức tính tốc độ của phản ứng trên là v = k.[H2].[I2]. Tốc độ của phản ứng hóa học trên sẽ tăng bao nhiêu lần khi tăng áp suất chung của hệ lên 3 lần?
A.tăng lên 3 lần.
B.tăng lên 9 lần .
C.tăng lên 6 lần.
D.tăng lên 12 lần.
Hướng dẫn giải:
Ta có: Áp suất tăng bao nhiêu lần thì nồng độ tăng bấy nhiêu lần.
Khi áp suất chung của hệ tăng 3 lần → [H2]’ = 3[H2]; [I2]’ = 3[I2]
→ Tốc độ phản ứng là:
→ Tốc độ phản ứng tăng 9 lần
Đáp án B
Bài 3:Cho phản ứng: A + B C. Nồng độ ban đầu của B là 0,8 mol/lít. Sau 10 phút, nồng độ của B chỉ còn 80% so với ban đầu. Tốc độ trung bình của phản ứng là:
A. 0,16 mol/lít.phút
B. 0,016mol/lít.phút
C. 1,6 mol/lít.phút
D. 0,106 mol/lít.phút
Hướng dẫn giải:
Nồng độ của chất B sau 10 phút là:
mol/lít
Tốc độ trung bình của phản ứng là:
mol/lít
Đáp án B
C. Bài tập minh họa
Bài 1: Cho phản ứng: Br2+ HCOOH → 2HBr + CO2. Nồng độ ban đầu của Br2là a mol/lít, sau 50 giây nồng độ Br2còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2là 4.10-5mol(lít.s)-1. Giá trị của a là :
A.0,018.
B.0,016.
C.0,012.
D.0,014.
Bài 2:Cho phản ứng . Ban đầu nồng độ oxi là 0,024 mol/lít. Sau 5s thì nồng độ của oxi là 0,02 mol/lít. Tốc độ phản ứng trên tính theo oxi là
A. 0,0008 mol./(l.s)
B. 1,1002 mol./(l.s)
C. 0,1006 mol./(l.s)
D. 2,1100 mol./(l.s)
Bài 3:Ở 30, sự phân hủy H2O2xảy ra theo phản ứng: 2H2O2 → 2H2O + O2↑
Dựa vào bảng số liệu sau, hãy tính tốc độ trung bình của phản ứng trong khoảng 120 giây đầu tiên.
|
Thời gian (s) |
0 |
60 |
120 |
240 |
|
Nồng độ H2O2(mol/l) |
0,3033 |
0,2610 |
0,2330 |
0,2058 |
A.2,929.10−4mol.(l.s)−1
B.5,858.10−4mol.(l.s)−1
C.4,667.10−4mol.(l.s)−1
D.2,333.10−4mol.(l.s)−1
Bài 4:Cho phản ứng: 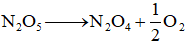 . Ban đầu nồng độ của N2O5là 1,91M; sau 207 giây nồng độ của N2O5 là 1,67M. Tốc độ trung bình của phản ứng tính theo N2O5là:
. Ban đầu nồng độ của N2O5là 1,91M; sau 207 giây nồng độ của N2O5 là 1,67M. Tốc độ trung bình của phản ứng tính theo N2O5là:
A. 3,8.10−4 mol/(l.s).
B. 1,16.10−3 mol/(l.s).
C. 1,72.10−3 mol/(l.s).
D. 1,8.10−3 mol/(l.s)
Bài 5:Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A.4,0.10-4mol/(l.s).
B.7,5.10-4mol/(l.s).
C.1,0.10-4mol/(l.s).
D.5,0.10-4mol/(l.s).
Bài 6:Xét phản ứng phân hủy N2O5trong dung môi CCl4ở 45 :
N2O5 → N2O4+ O2
Ban đầu nồng độ của N2O5là 2,33M, sau 184 giây nồng độ của N2O5là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5là
A.6,80.10-4mol/(l.s)
B.2,72.10-3mol/(l.s).
C.6,80.10-3mol/(l.s).
D.1,36.10-3mol/(l.s).
Bài 7:Tốc độ của một phản ứng có dạng: (A, B là 2 chất khác nhau). Nếu tăng nồng độ A lên 2 lần (nồng độ B không đổi) thì tốc độ phản ứng tăng 8 lần. Giá trị của x là
A. 3
B. 4
C. 6
D. 8
Bài 8:Cho phản ứng: A + B→ C. Nồng độ ban đầu của A là 0,1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là:
A. 1,6.10−2 mol/l.phút.
B.2,8.10−2 mol/l.phút
C. 4,3.10−3 mol/l.phút
D. 6,4.10−2mol/l.phút
Bài 9: Cho phương trình hóa học của phản ứng tổng hợp amoniac
N2(k) + 3H2(k) 2NH3(k)
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận sẽ
A.tăng lên 8 lần.
B. giảm đi 2 lần .
C. tăng lên 6 lần.
D. tăng lên 2 lần.
Bài 10:Cho phản ứng hóa học: A(k)+ 2B(k) → C(k)+ D(k)
Thực nghiệm cho thấy tốc độ của phản ứng hóa học trên được tính theo biểu thức: , trong đó k là hằng số tốc độ phản ứng; [A], [B] là nồng độ của các chất A, B. Hỏi tốc độ phản ứng tăng lên bao nhiêu lần nếu nồng độ chất B tăng 3 lần và nồng độ chất A không đổi?
A. 3
B. 6
C. 9
D. 12
Đáp án tham khảo
|
A. C |
2. A |
3. B |
4. B |
5. C |
6. D |
7. A |
8. D |
9. A |
10. C |