Anonymous
0
0
TOP 15 câu Trắc nghiệm Liên kết cộng hóa trị (có đáp án) - Hoá 10 Cánh diều
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hoá học10 Bài 11: Liên kết cộng hóa trị
Câu 1. Liên kết cộng hóa trị là liên kết hình thành bởi
A. lực hút tĩnh điện giữa các ion mang điện tích trái dấu
B. một cặp electron dùng chung giữa hai nguyên tử
C. một hay nhiều cặp electron dùng chung giữa hai nguyên tử
D. các electron hóa trị riêng
Đáp án: C
Giải thích:
Liên kết cộng hóa trị là liên kết hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
Câu 2.
(1) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực.
(2) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(3) Cặp electron dùng chung luôn được tạo nên tử 2 electron của cùng một nguyên tử.
(4) Cặp electron dùng chung được tạo nên tử 2 electron hóa trị.
Phát biểu đúng là
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Đáp án: D
Giải thích:
(1) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực. ⇒ Sai.
(2) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực. ⇒ Đúng.
(3) Cặp electron dùng chung luôn được tạo nên tử 2 electron của cùng một nguyên tử. ⇒ Sai.
Cặp electron dùng chung thường được tạo nên từ 2 electron của của hai nguyên tử. Ngoại trừ trường hợp liên kết cho nhận thì cặp electron dùng chung được đóng góp từ 1 nguyên tử.
(4) Cặp electron dùng chung được tạo nên tử 2 electron hóa trị. ⇒ Đúng.
Câu 3.
(1) Liên kết đôi được tạo nên từ 2 liên kết σ.
(2) Liên kết ba được tạo nên từ 2 liên kết σ và 1 liên kết π.
(3) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(4) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Phát biểu đúng là
A. (1) và (2)
B. (1) và (4)
C. (3) và (2)
D. (3) và (4)
Đáp án: D
Giải thích:
Phát biểu đúng là
(3) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(4) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Câu 4.
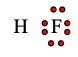
A. 2 electron dùng chung, 6 electron hóa trị riêng
B. 6 electron dùng chung, 2 electron hóa trị riêng
C. 1 electron dùng chung, 3 electron hóa trị riêng
D. 3 electron dùng chung, 1 electron hóa trị riêng
Đáp án: A
Giải thích:
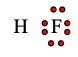
Giữa 2 nguyên tử có 2 dấu chấm ⇒ có 2 electron dùng chung.
Các phía còn lại của F có tổng cộng 6 chấm ⇒ có 6 electron hóa trị riêng.
Câu 5.
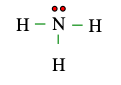
A. 2 electron dùng chung, 3 electron hóa trị riêng
B. 3 electron dùng chung, 2 electron hóa trị riêng
C. 6 electron dùng chung, 2 electron hóa trị riêng
D. 2 electron dùng chung, 6 electron hóa trị riêng
Đáp án: C
Giải thích:
Xung quanh nguyên tử N có tổng cộng 3 nối đơn (−) mà mỗi nối đơn biểu diễn 1 cặp electron dùng chung. ⇒ có 6 electron dùng chung.
Phía còn lại của nguyên tử N có 2 dấu chấm ⇒ có 2 electron hóa trị riêng.
Câu 6.
A. công thức phân tử
B. công thức electron
C. công thức Lewis
D. công thức đơn giản nhất
Đáp án: C
Giải thích: Công thức biểu diễn cấu tạo nguyên tử qua các liên kết (cặp electron dùng chung) và các electron hóa trị riêng là công thức Lewis.
Câu 7.
A. 1
B. 2
C. 3
D. 4
Đáp án: B
Giải thích:
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
C (Z = 6): [He]2s22p2 ⇒ có 4 electron lớp ngoài cùng ⇒ xu hướng nhận 4 electron để đạt cấu hình electron bền vững ⇒ góp 4 electron.
Công thức electron của phân tử CO2:
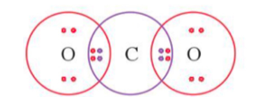
Vậy giữa 2 nguyên tử O và C có 2 cặp electron dùng chung.
Câu 8.
A. NaCl
B. K2O
C. CaO
D. H2O
Đáp án: D
Giải thích:
Hợp chất cộng hóa trị là hợp chất được tạo nên bởi liên kết cộng hóa trị.
Liên kết cộng hóa trị thường hình thành giữa phi kim và phi kim.
H và O đều là phi kim ⇒ Liên kết giữa H và O là liên kết cộng hóa trị.
⇒ Phân tử H2O thuộc loại hợp chất cộng hóa trị.
Câu 9. Liên kết trong phân tử nào dưới đây là liên kết ba?
A. NH3
B. CO2
C. O2
D. N2
Đáp án: D
Giải thích:
N (Z = 7): [He]2s22p3 ⇒ có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron bền vững ⇒ góp 3 electron.
Công thức electron của phân tử N2 là
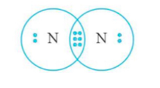
Công thức Lewis là
Vậy liên kết trong phân tử N2 là liên kết ba.
Câu 10.
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết đơn
Đáp án: B
Giải thích:
Có χ(H) = 2,2 và χ(Cl) = 3,16
Nên
Mà 0,4 ≤ 0,96 < 1,7 ⇒liên kết giữa nguyên tử H và Cl thuộc loại liên kết cộng hóa trị có cực.
Câu 11.
A. NaCl
B. CH4
C. H2O
D. HCl
Đáp án: B
Giải thích:
⇒ Liên kết trong phân tử NaCl là liên kết ion.
⇒ Liên kết trong phân tử CH4 là liên kết cộng hóa trị không cực.
mà 0,4 ≤ 1,24 < 1,7 ⇒ Liên kết trong phân tử H2O là liên kết cộng hóa trị có cực.
mà 0,4 ≤ 0,96 < 1,7 ⇒Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Câu 12.
A. 2 AO s xen phủ trục tạo liên kết đơn
B. 1 AO s và 1 AO p xen phủ trục tạo liên kết đơn
C. 2 AO p xen phủ trục tạo liên kết đơn
D. 2 AO ps xen phủ bên tạo liên kết đơn
Đáp án: C
Giải thích:
Cl (Z = 17): [Ne]3s23p5
Ô orbital của lớp electron ngoài cùng:
|
↑↓ |
↑↓ |
↑↓ |
↑ |
3s23p5
Có 1 AO p chứa electron độc thân.
Do đó liên kết đơn giữa 2 nguyên tử Cl trong phân tử Cl2 được tạo nên từ sự xen phủ trục của 2 AO p.
Câu 13.
A. Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (σ)
B. Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (π)
C. Liên kết đơn còn gọi là liên kết π
D. Liên kết đôi gồm một liên kết σ và một liên kết π, liên kết ba gồm một liên kết σ và hai liên kết π
Đáp án: C
Giải thích:
Liên kết đơn còn gọi là liên kết π là khẳng định sai.
⇒ Liên kết đơn còn gọi là liên kết σ.
Câu 14.
A. 464 kJ mol−1
B. 232 kJ mol−1
C. 928 kJ mol−1
D. 982 kJ mol−1
Đáp án: C
Giải thích: Trong phân tử H2O có hai liên kết O – H nên tổng năng lượng liên kết trong phân tử H2O là: 464.2 = 928 (kJ mol−1)
Câu 15.
A. HF
B. HCl
C. HBr
D. HI
Đáp án: A
Giải thích:
Năng lượng liên kết của liên kết H – F trong phân tử HF là 565 kJ mol−1.
Năng lượng liên kết của liên kết H – Cl trong phân tử HCl là 431 kJ mol−1.
Năng lượng liên kết của liên kết H – Br trong phân tử HBr là 364 kJ mol−1.
Năng lượng liên kết của liên kết H – I trong phân tử HI là 297 kJ mol−1.
Năng lượng liên kết của liên kết H – F lớn nhất. Do đó liên kết trong phân tử HF bền nhất.
Các câu hỏi trắc nghiệm Hoá họclớp 10 sách Cánh diều có đáp án, chọn lọc khác:
Trắc nghiệm Bài 12: Liên kết hydrogen và tương tác van der waals
Trắc nghiệm Bài 13: Phản ứng oxi hóa – khử
Trắc nghiệm Bài 14: Phản ứng hóa học và enthalpy
Trắc nghiệm Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học