Anonymous
0
0
Lý thuyết Phản ứng oxi hóa – khử (mới 2023 + Bài Tập) - Hóa học 8
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 8 Bài 32: Phản ứng oxi hóa – khử
Bài giảng Hóa 8 Bài 32: Phản ứng oxi hóa – khử
1. Sự khử. Sự oxi hóa
a) Sự khử
- Sự khử là sự tách oxi khỏi hợp chất.
- Ví dụ:
3H2 + Fe2O3 2Fe + 3H2O
- Quá trình tách nguyên tử oxi ra khỏi hợp chất Fe2O3, ta nói đã xảy ra sự khử Fe2O3 thành Fe.
- Ở các nhiệt độ cao khác nhau, khí H2 có thể chiếm được nguyên tố oxi của một số oxit kim loại khác, người ta nói: Trong các phản ứng hóa học này, xảy ra sự khử hoặc (sự khử oxi) oxit kim loại.
b) Sự oxi hóa
- Sự oxi hóa là sự tác dụng của oxi với một chất.
- Ví dụ:
3H2 + Fe2O3 2Fe + 3H2O
- Quá trình kết hợp của nguyên tử O trong Fe2O3 với H2, ta nói đã xảy ra sự oxi hóa H2 tạo thành H2O.
2. Chất khử. Chất oxi hóa
- Chất chiếm oxi của chất khác gọi là chất khử.
- Chất nhường oxi cho chất khác là chất oxi hóa.
Lưu ý: Trong phản ứng của oxi với các chất khác thì bản thân oxi là chất oxi hóa.
Ví dụ:
S + O2 SO2
- S là chất khử
- O2 chất oxi hóa
3. Phản ứng oxi hóa – khử
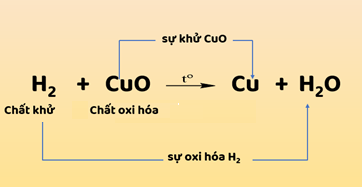
Hình 1: Sơ đồ biểu diễn quá trình sự khử và sự oxi hóa
- Sự khử và sự oxi hóa là hai quá trình tuy ngược nhau nhưng xảy ra đồng thời trong cùng một phản ứng hóa học. Phản ứng hóa học này được gọi là phản ứng oxi hóa – khử.
- Phản ứng oxi hóa – khử là phản ứng hóa trong đó xảy ra đồng thời sự oxi oxi hóa và sự khử.
4. Tầm quan trọng của phản ứng oxi hóa – khử
- Phản ứng oxi hóa khử là cơ sở của nhiều công nghệ sản xuất trong luyện kim và công nghiệp hóa học. Người ta sử dụng hợp lí các phản ứng oxi hóa – khử để tăng hiệu suất, nâng cao chất lượng sản phẩm.
- Nhiều phản ứng oxi hóa - khử diễn ra trong quá trình kim loại bị phá hủy trong tự nhiên. Người ta đã tìm được nhiều biện pháp hạn chế các phản ứng oxi hóa – khử không có lợi.
Trắc nghiệm Hóa 8 Bài 32: Phản ứng oxi hóa – khử
Câu 1:
A.sự oxi hóa.
B.sự khử.
C.sự phân hủy.
D.sự lên men.
Câu 2:
A.sự oxi hóa H2tạo thành H2O.
B.sự khử H2tạo thành H2O.
C.sự oxi hoá CuO tạo ra Cu.
D.sự phân hủy CuO thành Cu.
Câu 3:
A.Chất chiếm oxi của chất khác là chất khử.
B.Chất nhường oxi cho chất khác là chất oxi hóa.
C.Sự tác dụng của oxi với một chất là sự oxi hóa.
D.Trong phản ứng của oxi với cacbon, bản thân oxi cũng chất khử.
Câu 4:
A.CuO, H2.
B.H2, CuO.
C.Cu, H2O.
D.H2O, Cu.
Câu 5:
A.xảy ra đồng thời sự oxi hóa và sự khử.
B.chỉ xảy ra sự oxi hóa.
C.chỉ xảy ra sự khử.
D.không xảy ra sự oxi hóa và sự khử.
Câu 6:
A.C + O2 CO2.
B.Fe2O3+ 3CO 2Fe + 3CO2.
C.CaCO3 CaO + CO2.
D.3Fe + 2O2 Fe3O4.
Câu 7:
A.Phản ứng hóa học trênkhônglà phản ứng oxi hóa – khử.
B.Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3là chất oxi hóa, H2là chất khử.
C.Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3là chất khử, H2là chất oxi hóa.
D.Phản ứng hóa học trên là phản ứng phân hủy.
Câu 8:
(1) Sục khí CO2vào dung dịch Ca(OH)2.
(2) Cho khí H2qua sắt(III) oxit nung nóng.
(3) Đốt cháy Fe trong bình đựng khí Cl2.
(4) Sục khí SO2vào dung dịch KOH.
Số thí nghiệm có xảy ra phản ứng oxi hóa – khử là
A.1.
B.2.
C.3.
D.4.
Câu 9:
A.sự oxi hóa, sự khử.
B.sự khử, sự oxi hóa.
C.sự phân hủy, sự khử.
D.sự oxi hóa, sự phân hủy.
Câu 10:
(1) Nung nóng canxi cacbonat.
(2) Sắt tác dụng với lưu huỳnh.
(3) Khí CO đi qua đồng(II) oxit nung nóng.
Những biến đổi hóa học trên thuộc loại phản ứng nào?
A.(1) và (3) là phản ứng oxi hóa – khử, (2) là phản ứng hóa hợp.
B.(1) là phản ứng phân hủy, (2) là phản ứng hóa hợp, (3) là phản ứng oxi hóa – khử.
C.(1) là phản ứng phân hủy, (2) là phản ứng oxi hóa – khử, (3) là phản ứng hóa hợp.
D.(1) là phản ứng hóa hợp, (2) và (3) là phản ứng oxi hóa – khử.