Anonymous
0
0
Giải Hóa 10 Bài 9 ( Cánh diều): Quy tắc octet
- asked 6 months agoVotes
0Answers
0Views
Giải bài tập Hóa lớp 10 Bài 9: Quy tắc octet
Video giải bài tập Hóa lớp 10 Bài 9: Quy tắc octet
Mở đầu trang 49 Hóa học 10:Quan sát hiện tượng tự nhiên sau:
Trả lời:
Quá trình trên diễn ra theo xu hướng tạo nên hệ bền hơn (năng lượng thấp hơn).
I. Quy tắc octet
Câu hỏi 1 trang 49 Hóa học 10: Cho nguyên tử các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10), Ar (Z = 18). Những nguyên tử nào trong các nguyên tử trên có lớp electron ngoài cùng bền vững?
Trả lời:
Cấu hình electron nguyên tử của các nguyên tố lần lượt là:
Na (Z = 11): 1s22s22p63s1
Cl (Z = 17): 1s22s22p63s23p5
Ne (Z = 10): 1s22s22p6
Ar (Z = 18): 1s22s22p63s23p6
Nguyên tử Ne (Z = 10) và Ar (Z = 18) có lớp electron ngoài cùng bền vững (lớp electron ngoài cùng đã bão hòa với 8 electron).
II. Vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A
Câu hỏi 2 trang 50 Hóa học 10: Oxygen có Z = 8, cho biết xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học. Hãy vẽ sơ đồ minh họa quá trình đó.
Trả lời:
Cấu hình electron O (Z = 8): 1s22s22p4
Oxygen có 6 electron lớp ngoài cùng có xu hướng nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng (như của khí hiếm Ne) khi hình thành liên kết hóa học.
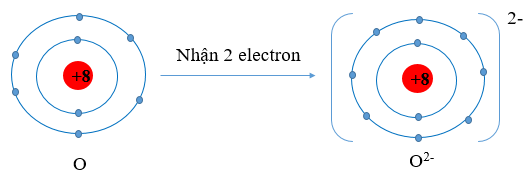
Sơ đồ nguyên tử O nhận thêm 2 electron vào lớp ngoài cùng:
Luyện tập 1 trang 50 Hóa học 10: Tính phi kim được đặc trưng bằng khả năng nhận electron. Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhường hay nhận bao nhiêu electron?
Trả lời:
O và F đều có tính phi kim ⇒ Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhận electron.
+ Ta có: Cấu hình electron O (Z = 8): 1s22s22p4 ⇒ Nguyên tử O sẽ nhận thêm 2 electron để được lớp vỏ có 8 electron lớp ngoài cùng bền vững.
+ Ta có: Cấu hình electron F (Z = 9): 1s22s22p5 ⇒ Nguyên tử F sẽ nhận thêm 1 electron để được lớp vỏ có 8 electron lớp ngoài cùng bền vững.
Luyện tập 2 trang 51 Hóa học 10: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ sơ đồ (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion.
Trả lời:
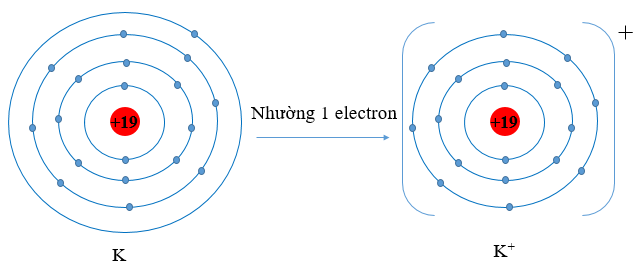
a) Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1. Vậy K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
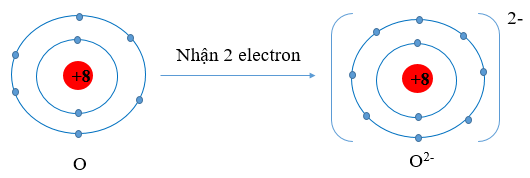
Cấu hình electron O (Z = 8): 1s22s22p4. Vậy O có 6 electron lớp vỏ ngoài cùng nên nguyên tử O có xu hướng nhận thêm 2 electron để trở thành ion mang điện tích âm, kí hiệu là O2-
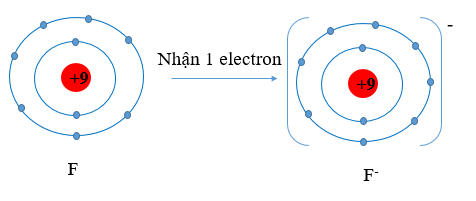
b) Cấu hình electron Li (Z = 3): 1s22s1. Vậy Li có 1 electron lớp vỏ ngoài cùng. Nguyên tử Li có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là Li+.

Cấu hình electron F (Z = 9): 1s22s22p5. Vậy F có 7 electron lớp vỏ ngoài cùng. Nguyên tử F có xu hướng nhận thêm 1 electron để trở thành ion mang điện tích âm, kí hiệu là F-.
c) Cấu hình electron Mg (Z = 12): 1s22s22p63s2. Vậy Mg có 2 electron lớp vỏ ngoài cùng. Nguyên tử Mg có xu hướng nhường đi 2 electron để trở thành ion mang điện tích dương, kí hiệu là Mg2+.
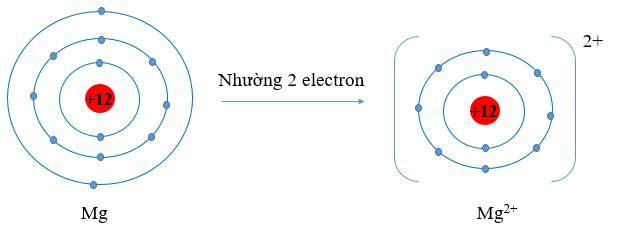
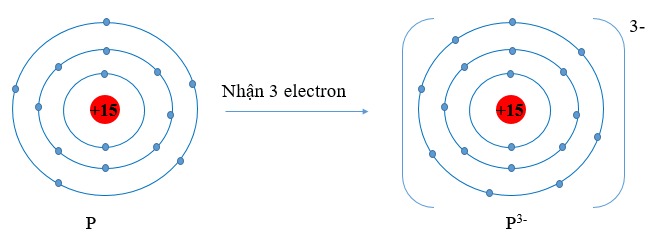
+ Cấu hình electron P (Z = 15): 1s22s22p63s23p3. Vậy P có 5 electron lớp vỏ ngoài cùng. Nguyên tử P có xu hướng nhận thêm 3 electron để trở thành ion mang điện tích âm, kí hiệu là P3-.
Luyện tập 3 trang 51 Hóa học 10:Vì sao nguyên tử của các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron ở lớp ngoài cùng (thỏa mãn quy tắc 8 electron khi tham gia liên kết)?
Trả lời:
Các nguyên tố thuộc chu kì 2, có 2 lớp electron. Lại có, lớp thứ 2 có 4 AO, mà mỗi AO có tối đa 2 electron nên các nguyên tố thuộc chu kì 2 chỉ có tối đa 8 electron.
Bài tập (trang 52)
Bài 1 trang 52 Hóa học 10: Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron.
B. Nhận 5 electron, nhường 5 electron.
C. Nhường 3 electron, nhận 3 electron.
D. Nhường 5 electron, nhận 5 electron.
Trả lời:
Đáp án đúng là: A
Nitrogen (Z = 7) có cấu hình electron là: 1s22s22p3
Lớp ngoài cùng của nguyên tử nitrogen có 5 electron, nên nguyên tử nitrogen có xu hướng nhận thêm 3 electron để đạt được cấu hình electron bền vững (8 electron ở lớp ngoài cùng).
Nhôm (Z = 13) có cấu hình electron là: 1s22s22p63s23p1
Lớp ngoài cùng của nguyên tử nhôm có 3 electron, nên nguyên tử nhôm có xu hướng nhường đi 3 electron để đạt được cấu hình electron bền vững (8 electron ở lớp ngoài cùng).
Bài 2 trang 52 Hóa học 10: Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
Trả lời:
Đáp án B
Cấu hình electron potassium (Z = 19): 1s22s22p63s23p64s1
Potassium có 1 electron lớp ngoài cùng nên có xu hướng nhường đi 1 electron này khi hình thành liên kết hóa học.
Bài 3 trang 52 Hóa học 10: Xu hướng tạo lớp vỏ bền vững hơn của các nguyên tử thể hiện như thế nào trong các trường hợp sau đây?
a) Kim loại điển hình tác dụng với phi kim điển hình.
b) Phi kim tác dụng với phi kim.
Trả lời:
a) Trong trường hợp kim loại điển hình tác dụng với phi kim điển hình, các nguyên tử kimloại sẽ có xu hướng nhường electron còn các nguyên tử phi kim sẽ có xu hướng nhận electron để hình thành liên kết hóa học.
b) Trong trường hợp phi kim tác dụng với phi kim, hai nguyên tử phi kim thường có xu hướng góp chung electron. Sau khi hình thành liên kết mỗi nguyên tử phi kim sẽ có 8 electron lớp ngoài cùng, giống lớp vỏ bền vững của khí hiếm.
Bài 4 trang 52 Hóa học 10: Ở dạng đơn chất, sodium (Na) và chlorine (Cl) rất dễ tham gia các phản ứng hóa học, nhưng muối ăn được tạo nên từ hai nguyên tố này lại không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron. Giải thích.
Trả lời:
- Ở dạng đơn chất, sodium (Na) có cấu hình electron là 1s22s22p63s1. Na có 1 electron lớp ngoài cùng. Nguyên tử Na dễ dàng nhường đi 1 electron để tạo thành ion Na+
- Ở dạng đơn chất, chlorine (Cl) có cấu hình electron là 1s22s22p63s23p5. Cl có 7 electron lớp ngoài cùng. Nguyên tử Cl dễ dàng nhận thêm 1 electron để tạo thành ion Cl-.
- Trong hợp chất NaCl (muối ăn) cả Na+ và Cl- đều đã có cấu hình bền vững của khí hiếm (với 8 electron ở lớp ngoài cùng) nên không dễ dàng tham gia các phản ứng mà có sự nhường hoặc nhận electron.
Bài 5* trang 52 Hóa học 10: Cho một số hydrocarbon sau: H-C≡C-H, H2C=CH2 và H3C-CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
Biết rằng mỗi gạch (-) trong các công thức trên biểu diễn hai electron hóa trị chung.
Trả lời:
a) Ta có, mỗi gạch trong các công thức H-C≡C-H, H2C=CH2 và H3C-CH3 biểu diễn hai electron hóa trị chung, do đó mỗi C đã đủ 8 electron ở lớp ngoài cùng; mỗi H đã đủ 2 electron ở lớp ngoài cùng (thõa mãn quy tắc octet).
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H.
Phân tử hydrocarbon có dạng: C3Hx
- Số các nguyên tử có hoá trị ≥ 2 là 3 (tức 3 C) ⇒ tổng số electron hoá trị là 3.4 = 12.
- Tổng số liên kết đơn giữa các nguyên tử có hoá trị ≥ 2 là: 3 – 1 = 2 ⇒ tổng số electron tham gia tạo liên kết là 2.2 = 4.
- Số H tối đa: x = 12 – 4 = 8.
I. Quy tắc octet
Quy tắc octet lần đầu được đưa ra bởi Lewis (nhà hóa học, vật lí người Mỹ) để lí giải xu hướng các nguyên tử trở nên bền vững hơn trong phản ứng hóa học.
- Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
- Các nguyên tử khí hiếm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác trong cùng chu kì nên rất khó tham gia các phản ứng hóa học. Điều này là do chúng có lớp electron ngoài cùng đã bão hòa với 8 electron (trừ He với 2 electron).
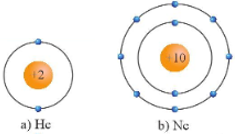
Hình 9.1. Mô hình cấu tạo nguyên tử của He và Ne
- Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm gần nhất để mỗi nguyên tử đó trở nên bền vững hơn.
II. Vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A
- Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững như của khí hiếm gần nhất với 8 electron ở lớp ngoài cùng (hoặc có 2 electron ở lớp ngoài cùng như của He).
Ví dụ 1: O (Z = 8) có cấu hình electron là 1s22s22p4
Oxygen có 6 electron lớp ngoài cùng. Vậy xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ar.
Sơ đồ nguyên tử O nhận thêm 2 electron vào lớp ngoài cùng:
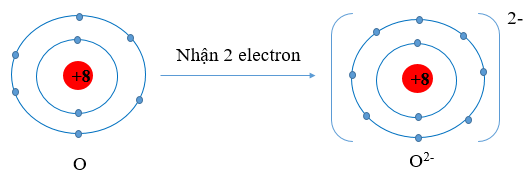 Hình 9.2. Sơ đồ nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng
Hình 9.2. Sơ đồ nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng
Ví dụ 2: K (Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1. Vậy K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
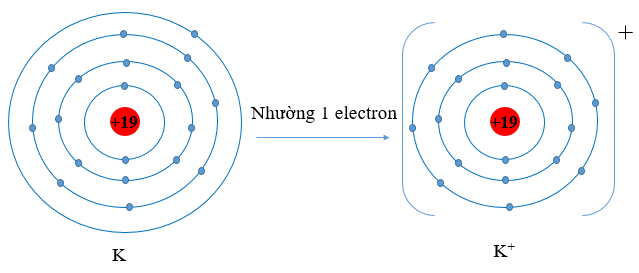
Hình 9.3. Sơ đồ nguyên tử potassium nhường đi 1 electron vào lớp ngoài cùng
Ví dụ 3: Nguyên tử N (Z = 7) có cấu hình electron là 1s22s22p3
Nguyên tử H (Z = 1) có cấu hình electron là 1s1
Để đạt được cấu hình của khí hiếm gần nhất, nguyên tử N cần thêm 3 electron, nguyên tử H cần thêm 1 electron. Vì vậy mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử N để tạo thành 3 cặp electron chung.
Các cặp electron chung cho phân tử NH3
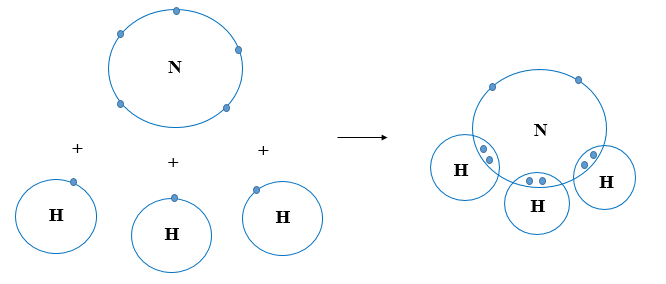
Hình 9.4. Sơ đồ góp chung electron của các nguyên tử trong phân tử NH3
Nhận xét:
- Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
- Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng (các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
- Ngoài cách các nguyên tử nhường và nhận electron để hình thành liên kết ion, quy tắc octet có thể đạt được bằng cách góp chung electron.
