Anonymous
0
0
Giải Hóa 10 Bài 18 (Kết nối tri thức): Ôn tập chương 5
- asked 6 months agoVotes
0Answers
1Views
Giải bài tập Hóa lớp 10 Bài 18: Ôn tập chương 5
I. Hệ thống hóa kiến thức
Hệ thống hóa kiến thức trang 89 Hóa học 10: Hoàn thành các nội dung còn thiếu sau đây:
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành (ở điều kiện chuẩn):
Tính biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí) theo năng lượng liên kết (ở điều kiện chuẩn):
Lời giải:
Chất phản ứng⟶ Sản phẩm,> 0 (phản ứng thu nhiệt)
< 0 (phản ứng tỏa nhiệt)
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành (ở điều kiện chuẩn):
Tính biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí) theo năng lượng liên kết (ở điều kiện chuẩn):
II. Luyện tập
Câu hỏi 1 trang 89 Hóa học 10: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ)⟶ P (s, trắng)= 17,6 kJ
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. toả nhiệt, P đỏ bền hơn P trắng.
D. toả nhiệt, P trắng bền hơn P đỏ.
Lời giải:
Đáp án đúng là: A
> 0 ⇒ Phản ứng thu nhiệt.
= (P, trắng) - (P, đỏ) > 0
⇒ (P, trắng) > (P, đỏ)
⇒ P trắng có mức năng lượng cao hơn tức là kém bền hơn P đỏ.
Câu hỏi 2 trang 89 Hóa học 10: Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO (g) + O2 (g) ⟶ CO2 (g)= -283,0 kJ
Biết nhiệt tạo thành chuẩn của CO2: (CO2(g)) = –393,5 kJ/mol.
Nhiệt tạo thành chuẩn của CO là
Lời giải:
Đáp án đúng là: A
= (CO2(g)).1 – [(CO(g)) + (O2(g)).]
⇒ - 283 = - 393,5.1 – [(CO(g)) + 0. ]
⇒(CO(g)) = - 110,5 kJ
Câu hỏi 3 trang 89 Hóa học 10: Dung dịch glucose (C6H12O6) 5%, có khối lượng riêng là 1,02 g/mL, phản ứng oxi hoá 1 mol glucose tạo thành CO2(g) và H2O(l) toả ra nhiệt lượng là 2 803,0 kJ.
Lời giải:
Đáp án đúng là: A
Khối lượng của glucose trong 500 mL dung dịch glucose 5% là
mglucose = = 25,5 gam
Oxi hóa 180 gam (1mol) glucosetoả ra nhiệt lượng là 2 803,0 kJ.
⇒ Oxi hóa 25,5 gam glucosetoả ra nhiệt lượng là kJ
Vậy năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là +397,09 kJ.
Câu hỏi 4 trang 90 Hóa học 10: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Liên kết | |||
Eb (kJ/mol) |
Biến thiên enthalpy của phản ứng C3H8(g) ⟶ CH4(g) + C2H4(g) có giá trị là
Lời giải:
Đáp án đúng là: C
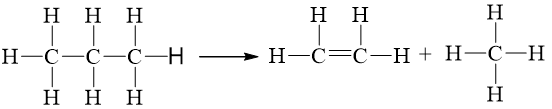
2.Eb(C – C) + 8.Eb(C – H) = 2.346 + 8.418 = 4036 kJ
1.Eb(C = C) + 8.Eb(C – H) = 1.612 + 8.418 = 3956 kJ
⇒ = 4036 – 3956 = +80 kJ
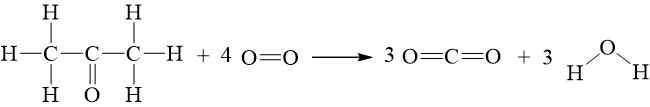
Câu hỏi 5 trang 90 Hóa học 10: Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l)= – 890,3 kJ
Lời giải:
= -
⇒ – 890,3 = [(– 393,5) + (– 285,8.2)] – [+ 0.2]
⇒= – 74,8 kJ/mol
Câu hỏi 6 trang 90 Hóa học 10: So sánh nhiệt tỏa ra khi đốt cháy hoàn toàn 1 kg cồn (C2H5OH) và 1 kg tristearin (C57H110O6, có trong mỡ lợn). Cho biết:
C2H5OH(l) + 3O2(g) ⟶ 2CO2(g) + 3H2O(l)= – 1 365 kJ
C57H110O6(s) + O2(g) ⟶ 57 CO2(g) + 55H2O(l)= – 35 807 kJ
Lời giải:
Đốt cháy 46 gam (1mol) C2H5OH tỏa ra lượng nhiệt là 1 365 kJ
⇒ Đốt cháy 1000 gam (1 kg) C2H5OH tỏa ra lượng nhiệt là kJ.
Đốt cháy 890 gam (1mol) C57H110O6 tỏa ra lượng nhiệt là 35 807 kJ.
⇒ Đốt cháy 1000 gam (1kg) C57H110O6 tỏa ra lượng nhiệt là kJ.
So sánh:
Nhiệt tỏa ra khi đốt cháy hoàn toàn 1 kg tristearin có trong mỡ lợn > khi đốt cháy hoàn toàn 1 kg cồn.
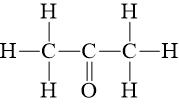
Câu hỏi 7 trang 90 Hóa học 10: Biết CH3COCH3 có công thức cấu tạo:
CH3COCH3(g) + 4O2(g) ⟶3CO2(g) + 3H2O(g)
Lời giải:
2.Eb(C – C) + 6.Eb(C – H) + 1.Eb(C = O) + 4.Eb(O = O)
= 2.346 + 6.418 + 1.732 + 4. 494 = 5908 kJ
6.Eb(C = O) + 6.Eb(O – H) = 6.732 + 6.459 = 7146 kJ
⇒ = 5908 – 7146 = - 1238 kJ
Câu hỏi 8 trang 90 Hóa học 10: Một bình gas (khí hoá lỏng) chứa hỗn hợp propane và butane với tỉ lệ số mol 1:2. Xác định nhiệt lượng toả ra khi đốt cháy hoàn toàn 12 kg khí gas trên ở điều kiện chuẩn.
C3H8(g) +5O2(g) ⟶3CO2(g) + 4H2O(1)= –2 220 kJ
C4H10(g)+ O2(g) ⟶4CO2(g) +5H2O (1)= –2 874 kJ
Lời giải:
Gọi x là số mol của propane trong bình gas.
⇒ 2x là số mol của butane trong bình gas.
Khối lượng 12 kg khí gas bằng 44x + 58.2x = 12.1000 (gam) ⇒ x = 75 (mol)
1 mol propane cháy tỏa ra 2 220 kJ nhiệt lượng.
1 mol butane cháy tỏa ra 2 874 kJ nhiệt lượng.
Tổng nhiệt lượng tỏa ra khi đốt cháy hoàn toàn một bình gas 12kg là:
75.2220 + 2.75.2874 = 597600 kJ
Số ngày mà hộ gia đình sử dụng hết bình gas là
≈ 48 ngày
Lý thuyết Ôn tập chương 5
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Ví dụ: Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
II. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
Ở điều kiện chuẩn: (cđ).
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
Ví dụ: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
CO(g) + O2(g) CO2(g)
biết nhiệt tạo thành chuẩn của CO2(g) là –393,5 kJ/mol, của CO(g) là –110,5 kJ/mol.
Hướng dẫn giải:
= –393,5 – (–110,5 + 0×![]() ) = –283 (kJ).
) = –283 (kJ).
III. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
Ở điều kiện chuẩn: = (cđ) – .
Ví dụ: Tính biến thiên enthalpy chuẩn của phản ứng
C3H8(g) CH4(g) + C2H4(g)
biết năng lượng liên kết (ở điều kiện chuẩn):

Hướng dẫn giải:
= 3Eb (C–C) + 8Eb (C–H) – 4Eb (C–H) – 2Eb (C=C) – 4Eb (C–H)
= 3×346 + 8×418 – 4×418 – 2×612 – 4×418 = –186 (kJ).