Anonymous
0
0
TOP 15 câu Trắc nghiệm Ôn tập chương 7 (Kết nối tri thức 2024) có đáp án - Hóa học 10
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa học 10 Bài 23: Ôn tập chương 7 - Kết nối tri thức
Câu 1.
A. iodine.
B. chlorine.
C. fluorine.
D. bromine.
Đáp án: A
Giải thích:
Rong biển chứa nguyên tố iodine.
Câu 2. Các nguyên tử halogen
A. dễ nhường đi 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
B. dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
C. dễ nhường đi 2 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
D. dễ nhận thêm 2 electron để đạt được cấu hình electron bền của khí hiếm gần nhất.
Đáp án: B
Giải thích:
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e ns2np6
Câu 3.
A. Iodine.
B. Bromine.
C. Fluorine.
D. Chlorine.
Đáp án: C
Giải thích:
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e ® ns2np6
Do vậy, số oxi hóa đặc trưng của các halogen trong hợp chất là –1.
Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hóa dương: +1, +3, +5, +7. Tuy nhiên, fluorine có độ âm điện lớn nhất, nên fluorine luôn có số oxi hóa bằng –1 trong mọi hợp chất.
Câu 4. Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2, liên kết hóa học trong phân tử X2 là
A. liên kết ion.
B. liên kết cộng hóa trị không cực.
C. liên kết cộng hóa trị phân cực.
D. liên kết cho – nhận.
Đáp án: B
Giải thích:
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2, liên kết hóa học trong phân tử X2 là liên kết cộng hóa trị không phân cực.
Câu 5. Ở điều kiện thường, đơn chất chlorine
A. ở thể khí, màu lục nhạt.
B. ở thể lỏng, màu lục nhạt.
C. ở thể khí, màu vàng lục.
D. ở thể lỏng, màu vàng lục.
Đáp án: C
Giải thích:
Ở điều kiện thường, đơn chất chlorine (Cl2) ở thể khí, màu vàng lục.
Câu 6.
A. ít tan trong nước và trong dung môi hữu cơ như alcohol, benzene.
B. tan nhiều trong nước và trong dung môi hữu cơ như alcohol, benzene.
C. tan nhiều trong nước nhưng tan ít trong dung môi hữu cơ như alcohol, benzene.
D. ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene.
Đáp án: D
Giải thích:
Ở điều kiện thường, các halogen ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene.
Câu 7. Đi từ fluorine đến iodine, tính oxi hóa
A. giảm dần.
B. tăng dần.
C. tăng sau đó giảm dần.
D. giảm sau đó tăng dần.
Đáp án: A
Giải thích:
Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
Câu 8. Đơn chất halogen nào sau đây phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2?
A. F2.
B. Cl2.
C. Br2.
D. I2.
Đáp án: A
Giải thích:
F2 phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2:
2F2 + 2H2O ® 4HF + O2
Các halogen Cl2, Br2 và I2 phản ứng chậm với nước và mức độ phản ứng giảm dần từ Cl2 đến I2.
Câu 9. Nước Javel được dùng làm chất tẩy rửa, khử trùng. Nước Javel chứa
A. HClO và HCl.
B. NaClO, NaCl và một phần NaOH dư.
C. NaClO và một phần NaOH dư.
D. NaCl và một phần NaOH dư.
Đáp án: B
Giải thích:
Chlorine phản ứng với dung dịch sodium hydroxide ở điều kiện thường, tạo thành nước Javel (Gia-ven):
Cl2 + 2NaOH ® NaCl + NaClO + H2O
Nước Javel (chứa NaClO (sodium hypochlorite), NaCl và một phần NaOH dư) được dùng làm chất tẩy rửa, khử trùng.
Câu 10.
A. NaF.
B. NaCl.
C. NaBr.
D. NaI.
Đáp án: D
Giải thích:
Bromine có thể oxi hóa ion I- trong dung dịch muối iodine.
Br2 + 2NaI ® 2NaBr + I2
Câu 11. Trong phòng thí nghiệm, để điều chế chlorine, ta có thể
A. cho kim loại mạnh tác dụng với hydrochloric acid đặc (HCl).
B. cho quặng pyrolusite (MnO2) tác dụng với hydrochloric acid đặc (HCl).
C. điện phân dung dịch muối ăn bão hòa, có màng ngăn giữa các điện cực.
D. điện phân dung dịch HCl.
Đáp án: B
Giải thích:
Điều chế chlorine (Cl2) trong phòng thí nghiệm:
Cho quặng pyrolusite (MnO2) tác dụng với hydrochloric acid đặc:
MnO2 + 4HCl(đặc) ![]() MnCl2 + Cl2 + 2H2O
MnCl2 + Cl2 + 2H2O
Ngoài ra, còn có thể thay MnO2 bằng KMnO4 rắn để điều chế khí Cl2:
2KMnO4 + 16HCl(đặc) ![]() 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu 12.
A. HF.
B. HCl.
C. HBr.
D. HI.
Đáp án: A
Giải thích:
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen:
![]()
Câu 13. Trong dãy hydrohalic acid, từ HF đến HI, tính acid
A. giảm dần.
B. tăng dần.
C. không thay đổi.
D. tăng sau đó giảm.
Đáp án: B
Giải thích:
Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
Câu 14.
A. HF.
B. HCl.
C. HBr.
D. HI.
Đáp án: A
Giải thích:
Hydrogen fluoride được sử dụng trong quá trình sản xuất teflon (dùng làm chất chống dính ở nồi, chảo) theo sơ đồ:
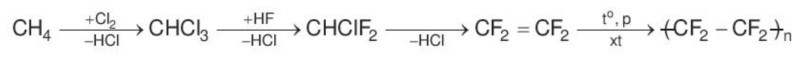
Câu 15.
A. dung dịch HCl.
B. dung dịch BaCl2.
C. dung dịch Ba(OH)2.
D. dung dịch AgNO3.
Đáp án: D
Giải thích:
Phân biệt các dung dịch: NaF, NaCl, NaBr, NaI.
Dùng dung dịch AgNO3.
+ Không có hiện tượng gì là dung dịch NaF.
+ Xuất hiện kết tủa màu trắng là dung dịch NaCl.
NaCl + AgNO3® NaNO3 + AgCl¯
+ Xuất hiện kết tủa màu vàng nhạt là dung dịch NaBr.
NaBr + AgNO3® NaNO3 + AgBr¯
+ Xuất hiện kết tủa màu vàng là dung dịch NaI.
NaI + AgNO3® NaNO3 + AgI¯
Các câu hỏi trắc nghiệm Hóa học lớp 10 sách Kết nối tri thức có đáp án, chọn lọc khác:
Trắc nghiệm Bài 18: Ôn tập chương 5
Trắc nghiệm Bài 19: Tốc độ phản ứng
Trắc nghiệm Bài 20: Ôn tập chương 6