Anonymous
0
0
Sách bài tập Hóa 11 Bài 3 (Kết nối tri thức): Ôn tập chương 1
- asked 6 months agoVotes
0Answers
0Views
Giải SBT Hóa 11 Bài 3: Ôn tập chương 1
Bài 3.1 trang 12 SBT Hóa 11
Biểu thức hằng số cân bằng của phản ứng trên là
A. ,
B. .
C. .
D. .
Lời giải:
Đáp án đúng là: AHằng số cân bằng của phản ứng là
Bài 3.2 trang 12 SBT Hóa 11:
Biểu thức hằng số cân bằng của phản ứng trên là
A.
B.
C. .
D. .
Lời giải:
Đáp án đúng là: B
Hằng số cân bằng của phản ứng là
Bài 3.3 trang 12 SBT Hóa 11:
Nhận xét nào sau đây không đúng?
A. Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
B. Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
C. Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
D. Phản ứng thuận là phản ứng toả nhiệt.
Lời giải:
Đáp án đúng là: B
Tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là giảm số mol khí. Vậy cân bằng phải chuyển dịch theo chiều thuận.
Bài 3.4 trang 13 SBT Hóa 11:
Ở ToC, nồng độ các chất ở trạng thái cân bằng như sau:
và .
Hằng số cân bằng của phản ứng tại ToC là
A. 1,276.10-2.
B.4,375.10-2.
C. 78,36.
D. 22,85.
Lời giải:
Đáp án đúng là: A
Hằng số cân bằng của phản ứng
Bài 3.5 trang 13 SBT Hóa 11:
A.FeCl3.
B.KCl.
C.Na2CO3.
D.Na2SO4.
Lời giải:
Đáp án đúng là: A
pH < 7 ứng với môi trường acid, muối FeCl3 là muối chứa cation kim loại trung bình.
Bài 3.6 trang 13 SBT Hóa 11:
A.H2SO4.
B.HCl.
C.NH3.
D.NaOH.
Lời giải:
Đáp án đúng là: D
pH càng cao, tính base càng mạnh. Vậy với cùng một nồng độ, dung dịch có pH cao nhất là NaOH.
Bài 3.7 trang 13 SBT Hóa 11:
Ở430oC, nồng độ các chất ở trạng thái cân bằng là: [H2] = [I2] = 0,107 mol/L; [HI] = 0,786 mol/L.
a) Tính hằng số cân bằng (Kc) của phản ứng ở430oC.
b) Nếu cho 2 mol H2 và 2 mol I2 vào bình kín dung tích 10 lít, giữ bình ở 430oC thì nồng độ các chất ở trạng thái cân bằng là bao nhiêu?
Lời giải:
a) Hằng số cân bằng của phản ứng là

Lời giải:
Phương trình phản ứng:
Phản ứng thuận: H2O là acid, CH3-NH2 là base, phản ứng nghịch CH3-NH3+ là acid, OH- là base.
Dung dịch CH3NH2 có pH > 7, môi trường base.
Bài 3.9 trang 13 SBT Hóa 11:
Lời giải:
Phương trình điện li của các acid:
Nồng độ H+ trong dung dịch H2SO4 > HCl > CH3COOH.
pH (H2SO4) < pH (HCl) < pH (CH3COOH).
Bài 3.10 trang 13 SBT Hóa 11:
a) 5 mL dung dịch A và 10 mL dung dịch B.
b) 5 mL dung dịch B vào 10 mL dung dịch A.
c) 10 mL dung dịch B vào 10 mL dung dịch A.
Lời giải:
Phản ứng xảy ra khi trộn các dung dịch:
NaOH + HCl → NaCl + H2O
a) Sau khi phản ứng, số mol NaOH dư là: 5.10-3.0,1 = 5.10-4 (mol)
pH = 12,52.
b) Sau phản ứng, số mol HCl dư: 5.10-3.0,1 = 5.10-4 (mol)
pH = 1,48.
c) Sau phản ứng, dung dịch chỉ có NaCl, pH = 7.
Bài 3.11 trang 14 SBT Hóa 11:
Lời giải:
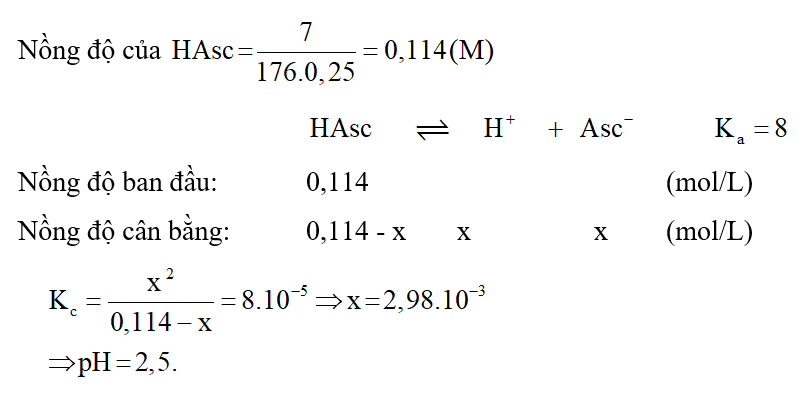
Bài 3.12 trang 14 SBT Hóa 11:
Lời giải:
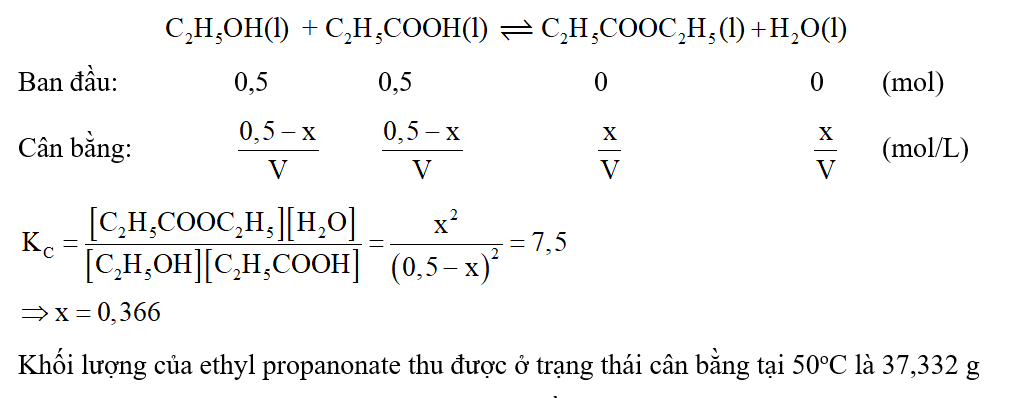
Bài 3.13 trang 14 SBT Hóa 11:
a) Xác định số mol các chất ở trạng thái cân bằng.
b) Tính hằng số cân bằng của phản ứng ở nhiệt độ trên.
c) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nào?
Lời giải:
a)
Ban đầu: 1,0 3,0 (mol)
Phản ứng: 0,2 0,6 0,4 (mol)
Cân bằng: 0,8 2,4 0,4 (mol)
Nồng độ: 0,08 0,24 0,04 (mol)
b)
c) Nếu tăng nhiệt độ của bình phản ứng: cân bằng chuyển dịch theo chiều thu nhiệt tức là theo chiều nghịch, Kc giảm.
Bài 3.14 trang 14 SBT Hóa 11:
b) Trong dung dịch nước ion CH3COO- nhận proton của nước. Viết phương trình thuỷ phân và cho biết môi trường của dung dịch CH3COONa.
c) Cho 10 mL dung dịch NaOH 0,1 M vào 10 mL dung dịch CH3COOH 0,2 M thu được 20 mL dung dịch A. Tính pH của dung dịch A.
Lời giải:
a) Phương trình phân li xảy ra như sau:
b)
Phương trình thủy phân của ion CH3COO-:
CH3COO- + H2O ⇌ CH3COOH + OH-
Dung dịch CH3COONa có môi trường base.
c) Phản ứng :
Ban đầu: 2.10-3 1.10-3 (mol)
Phản ứng: 1.10-3 0 1.10-3 (mol)
Sau phản ứng: 1.10-3 1.10-3 (mol)
Nồng độ: 0,05 0,05 (mol/L)
Xét cân bằng hóa học sau:
Ban đầu: 0,05 0,05 0 (mol/L)
Cân bằng: 0,05 - x 0,05 + x x (mol/L)
.
Bài 3.15 trang 14 SBT Hóa 11:
a) Tính nồng độ CM của dung dịch A.
c) Nêu một số nguyên nhân dẫn đến việc sai khác nồng độ dung dịch A trong câu a và b.
Lời giải:
Số mol NaOH = 0,02655 mol.
a) CM của dung dịch A = 0,1062 M
b) Phản ứng chuẩn độ: HCl + NaOH → NaCl + H2O
Nồng độ dung dịch NaOH =
c) Một số nguyên nhân dẫn đến việc sai khác nồng độ dung dịch A: NaOH hút ẩm trong không khí, hấp thụ một lượng nhỏ khí CO2 trong không khí.