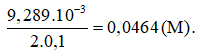Anonymous
0
0
Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50,0 mL
- asked 6 months agoVotes
0Answers
0Views
Giải SBT Hóa học 11 Bài 3: PH của dung dịch. Chuẩn độ acid – base
Bài 3.13 trang 12 SBT Hóa học 11: Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50,0 mL dung dịch NaOH 0,213 M vào 100 mL dung dịch mẫu A rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion OH–. Phần ion dư này cần 13,21 mL HCl 0,103 M để trung hoà. Tính nồng độ mol L–1 của mẫu A.
Lời giải:
Phương trình hoá học của các phản ứng xảy ra như sau:
2NaOH + H2SO4 ⟶ Na2SO4 + 2H2O
HCl + NaOH ⟶ NaCl + H2O
Số mol NaOH thêm vào 100 mL dung dịch H2SO4 là: 0,05.0,213 = 1,065.10-2 (mol). Số mol NaOH được trung hoà bởi HCl là: 0,01321.0,103 = 1,361.10-3 (mol).
Số mol NaOH được trung hoà bởi 100 mL dung dịch H2SO4 là:
1,065.10-2 – 1,361.10-3 = 9,289.10-3 (mol).
Vậy nồng độ H2SO4 trong mẫu phân tích là: