Anonymous
0
0
Lý thuyết Nước (mới 2023 + Bài Tập) - Hóa học 8
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 8 Bài 36: Nước
Bài giảng Hóa 8 Bài 36: Nước
I. Thành phần hóa học
1. Sự phân hủy nước
- Khi tiến hành điện phân nước bằng dòng điện một chiều, trên bề mặt hai điện cực sinh ra khí hiđro và oxi với tỉ lệ thể tích là 2:1.
- Phương trình hóa học:
2H2O 2H2↑ + O2↑
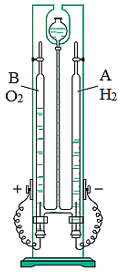
Hình 1: Phân hủy nước bằng dòng điện
2. Sự tổng hợp nước
Thí nghiệm: Cho nước vào đầy ống thủy tinh hình trụ. Cho vào ống lần lượt 2 thể tích khí hiđro và 2 thể tích khí oxi.
→ Mực nước trong ống ở vạch số 4.
Đốt bằng tia lửa điện hỗn hợp khí, ta thấy sau cùng hỗn hợp chỉ còn 1 thể tích oxi. Vậy 1 thể tích oxi đã hóa hợp với 2 thể tích hiđro tạo thành nước.
Phương trình hóa học:
2H2 + O2 2H2O
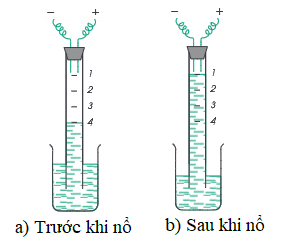
Hình 2: Tổng hợp nước
Kết luận:
- Nước là hợp chất tạo bởi 2 nguyên tố oxi và hiđro. Chúng đã hóa hợp với nhau
- Bằng thực nghiệm, người ta tìm được công thức hóa học của nước là H2O.
II. Tính chất của nước
1. Tính chất vật lý
- Nước là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị, sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C thành nước đá và tuyết.
- Khối lượng riêng ở 4°C là 1 g/ml (hay 1kg/lít).
2. Tính chất hóa học
a) Tác dụng với kim loại: Nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Na, Ca, Ba, K,…
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2↑
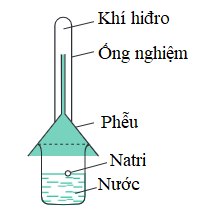
Hình 3: Phản ứng của nước với natri
b) Tác dụng với một số oxit bazơ như CaO, K2O,… tạo ra bazơ tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh.
Phương trình hóa học:
K2O + H2O → 2KOH
c) Tác dụng với một số oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ.
Phương trình hóa học:
SO3 + H2O → H2SO4
III. Vai trò của nước và cách chống ô nhiễm nguồn nước:
- Vai trò của nước trong đời sống và sản xuất:
+ Hòa tan chất dinh dưỡng cho cơ thể sống

Hình 4: Dịch truyền tĩnh mạch glucose 5%
+ Tham gia vào quá trình hóa học trong cơ thể người và động vật.
+ Tham gia quá trình quang hợp của cây xanh
6CO2 + 6H2O C6H12O6 + 6O2↑
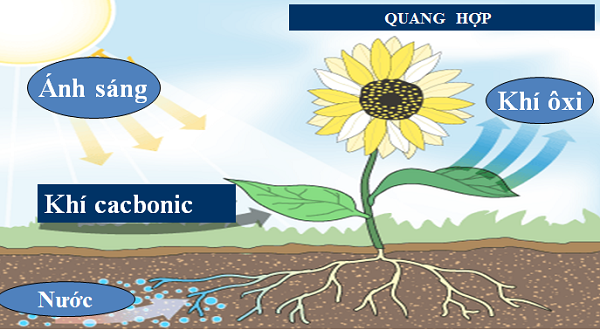
Hình 5: Mô hình quang hợp của cây xanh
+ Có vai trò rất quan trọng trong đời sống: sản xuất công nghiệp, nông nghiệp, giao thông vận tải,…

Hình 6: Một số ứng dụng của nước trong sản xuất, chăn nuôi
- Cách chống ô nhiễm nguồn nước:
+ Không vứt rác thải xuống nguồn nước.
+ Xử lý nước thải trước khi cho nước thải chảy vào sông, hồ, biển.
- Lượng nước ngọt là rất nhỏ so với lượng nước trên Trái Đất. Nhiều nguồn nước ngọt đang bị ô nhiễm nặng do đó cần phải sử dụng tiết kiệm nước.
Trắc nghiệm Hóa 8 Bài 36: Nước
Câu 1:
A.H2O2.
B.H2O.
C.H3O.
D.HO2.
Câu 2:
A.khí hiđro và khí oxi.
B.khí hiđro và khí cacbon oxit.
C.khí oxi và khí cacbon oxit.
D.khí hiđro và khí clo.
Câu 3:
A.1 : 3.
B.5 : 6.
C.1 : 8.
D.2 : 7.
Câu 4:
A.88,9%.
B.11,1%.
C.16,2%.
D.83,8%.
Câu 5:
A.Nước là chất lỏng không màu (tuy nhiên lớp nước dày thì có màu xanh da trời).
B.Nước là chất lỏng không màu, không mùi, không vị.
C.Nước sôi ở nhiệt độ trên 100oC và hoá rắn ở 0oC thành nước đá và tuyết.
D.Nước có thể hoà tan được nhiều chất rắn (đường, muối ăn …), chất lỏng (cồn, axit …), chất khí (HCl, NH3…).
Câu 6:
A.Mg.
B.Cu.
C.Fe.
D.Na.
Câu 7:
A.CaO.
B.SO3.
C.Al2O3.
D.CuO.
Câu 8:
A.H2CO3, H2SO3, H3PO4, HNO2.
B.H2CO3, H2SO3, H3PO3, HNO2.
C.H2CO3, H2SO4, H3PO3, HNO3.
D.H2CO3, H2SO4, H3PO4, HNO3.
Câu 9:
A.NaOH.
B.K2SO4.
C.NaNO3.
D.HNO3.
Câu 10:
A.nước.
B.nước và quỳ tím.
C.dung dịch HCl.
D.dung dịch H2SO4.