Anonymous
0
0
Lý thuyết Dãy hoạt động hóa học của kim loại (mới 2024 + Bài Tập) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 9 Bài 17: Dãy hoạt động hóa học của kim loại
Bài giảng Hóa 9 Bài 17: Dãy hoạt động hóa học của kim loại
I. Dãy hoạt động hóa học của kim loại được xây dựng như thế nào?
- Bằng nhiều thí nghiệm khác nhau, người ta sắp xếp kim loại thành dãy, theo chiều giảm dần mức độ hóa học.
- Các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học :
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
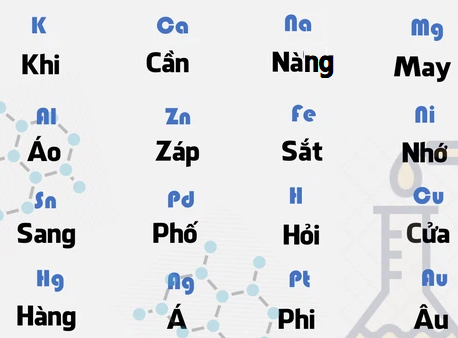
Hình 1: Cách nhớ dãy hoạt động hóa học của kim loại
II. Dãy hoạt động hóa học của kim loại có ý nghĩa như thế nào?
Dãy hoạt động hóa học của kim loại cho biết:
1. Mức độ hoạt động hóa học của các kim loại giảm dần từ trái sang phải.

2. Những kim loại đứng trước Mg là những kim loại mạnh (K, Na, Ba,..), tác dụng với nước ở điều kiện thường tạo thành kiềm và giải phóng H2.
Phương trình hóa học minh họa:
2K + 2H2O → 2KOH + H2 ↑
2Na + 2H2O → 2NaOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Ba + 2H2O → Ba(OH)2 + H2 ↑

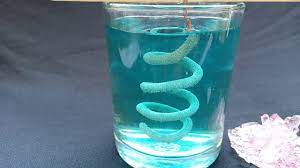
Hình 2: Canxi tác dụng với nước
3. Kim loại đứng trước H phản ứng với một số dung dịch axit giải phóng khí H2.
Phương trình hóa học minh họa:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
Mg + 2HCl → MgCl2 + H2 (↑)

Hình 3: Nhôm tác dụng với H2SO4 loãng
Phương trình hóa học minh họa:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Hình 4: Đồng tác dụng với dung dịch AgNO3
Trắc nghiệm Hóa học 9 Bài 17: Dãy hoạt động hóa học của kim loại
Câu 1:
A.Na, Mg, Zn.
B.Al, Zn, Na.
C.Mg, Al, Na.
D.Pb, Al, Mg.
Câu 2:
A.Al , Zn, Fe
B.Zn, Pb, Au
C.Mg, Fe, Ag
D.Na, Mg, Al
Câu 3:
A.Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
B.Kim loại kiềm và kim loại kiềm thổ đều phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí H2.
C.Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4 loãng, …) giải phóng khí H2.
D. Kim loại đứng trước (trừ Na, K,…) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Câu 4:
A.MgSO4
B.Al2(SO4)3
C.H2SO4loãng
D.H2SO4đặc, nóng
Câu 5:
A.Zn.
B.Mg.
C.Fe.
D.Cu.
Câu 6:
A.Al giải phóng hiđro nhiều hơn Zn .
B.Zn giải phóng hiđro nhiều hơn Al.
C.Al và Zn giải phóng cùng một lượng hiđro.
D.Lượng hiđro do Al sinh ra bằng 2,5 lần do Zn sinh ra .
Câu 7:
A.8,125 gam.
B.0,8125 gam.
C.2,125 gam.
D.0,2125 gam.
Câu 8:
A.10,8 gam.
B.21,6 gam.
C.1,08 gam.
D.2,16 gam.
Câu 9:
A.Ca.
B.Mg.
C.Fe.
D.Ba.
Câu 10:
A.Viên natri tan dần, sủi bọt khí, dung dịch không đổi màu.
B.Viên natri tan dần,không có khí thoát ra, có kết tủa màu xanh.
C.Viên natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh.
D.Không có hiện tượng.