Anonymous
0
0
Lý thuyết Phản ứng trao đổi ion trong dung dịch các chất điện li (mới 2023 + Bài Tập) - Hóa học 11
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài giảng Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
1. Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓

Kết tủa BaSO4
+ Phản ứng tạo thành chất điện li yếu:
HCl + NaOH → NaCl + H2O
+ Phản ứng tạo thành chất khí:
Fe + H2SO4 loãng → FeSO4 + H2↑
2. Phương trình ion rút gọn
- Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Cách chuyển từ phương trình dưới dạng phân tử thành phương trình ion rút gọn như sau:
Bước 1:
+ Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion.
+ Các chất khí, chất kết tủa, chất điện li yếu để nguyên ở dạng phân tử.
⇒ Khi này, phương trình thu được gọi là phương trình ion đầy đủ.
Thí dụ: Xét phản ứng:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
Phương trình ion đầy đủ là:
2Na+ ++ Ba2+ + 2Cl- → BaSO4↓ + 2Na+ + 2Cl-
Bước 2: Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn.
Ba2+ +→ BaSO4↓
Từ phương trình này ta thấy rằng, muốn điều chế kết tủa BaSO4 chỉ cần trộn 2 dung dịch, một dung dịch chứa Ba2+, dung dịch kia chứa ion SO42-.
Trắc nghiệm Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu 1:
A. Na+,, Mg2+,
B. K+, H+,,
C., Mg+, Ca2+,
D., Na+, Ba2+,
Đáp án: A
Giải thích:
![]()
Câu 2:
A.H++ OH–→ H2O
B.Ba2++ 2OH–+ 2H++ 2Cl–→ BaCl2+ 2H2O
C.Ba2++ 2Cl–→ BaCl2
D.Cl–+ H+→ HCl
Đáp án: A
Giải thích:
Phương trình phân tử:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Phương trình ion đầy đủ:
Ba2+ + 2OH– + 2H+ + 2 → Ba2+ + 2 + 2H2O
Phương trình ion rút gọn:
H+ + OH– → H2O
Câu 3:
Phương trình ion thu gọn của phản ứng trên là
A.HCl + OH – → H2O +.
B.2H+ + Mg(OH)2 → Mg2+ + 2H2O.
C.H+ + OH – → H2O.
D.2HCl + Mg(OH)2 → Mg2+ + 2 + 2H2O.
Đáp án: B
Giải thích:
Ta có phản ứng: Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
Phương trình ion đầy đủ là:
Mg(OH)2 + 2H+ + 2 → Mg2+ + 2 + 2H2O.
→ Phương trình ion thu gọn là: Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
Câu 4:
A.Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2.
B.H2SO4 + BaCO3 → BaSO4 + CO2 + H2O.
C.Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3.
D.H2SO4 + Ba(OH)2 → BaSO4 + 2H2O.
Đáp án: C
Giải thích: 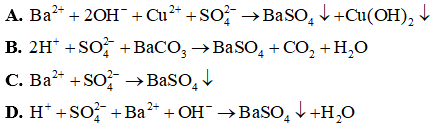
Câu 5:
A.2Al + 3H2SO4→ Al2(SO4)3+ 3H2
B.2HCl + FeS → FeCl2+ H2S
C.NaOH + HCl → NaCl + H2O
D.Cu + 2AgNO3→ Cu(NO3)2+ 2Ag
Đáp án: C
Giải thích: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất điện li yếu, chất khí.
Câu 6:
A.K+.
B.H+.
C.
D.Fe3+.
Đáp án: A
Giải thích:
A. K+ không phản ứng được với
B.
C.
D.
Câu7:
B.2.
C.3.
D.4.
Đáp án: D
Câu8:
(1) NaHS + NaOH
(2) Ba(HS)2+ KOH
(3) Na2S + HCl
(4) CuSO4+ Na2S
(5) FeS + HCl
(6) NH4HS + NaOH
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A.(3), (4), (5).
B.(1), (2).
C.(1), (2), (6).
D.(1), (6).
Đáp án: B
Giải thích:
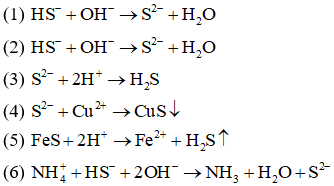
Câu9:
(1) CaCl2+ Na2CO3
(2) Ca(OH)2+ CO2
(3) Ca(HCO3)2+ NaOH
(4) Ca(NO3)2+ (NH4)2CO3
A.(1) và (2).
B.(2) và (3).
C.(1) và (4).
D.(2) và (4).
Đáp án: C
Giải thích:
(1), (4) có cùng phương trình ion thu gọn là
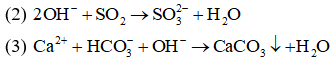
Câu10:
A.Zn + H2SO4 ZnSO4+ H2
B.Fe(NO3)3+ 3NaOH Fe(OH)3+ 3NaNO3
C.2Fe(NO3)3+ 2KI 2Fe(NO3)2+ I2+ 2KNO3
D.Zn + 2Fe(NO3)3 Zn(NO3)2+ 2Fe(NO3)2
Đáp án: B
Giải thích:
A, C, D là phản ứng oxi hóa khử
B là phản ứng trao đổi ion trong dung dịch: