Anonymous
0
0
Lý thuyết Amoniac và muối amoni (mới 2023 + Bài Tập) - Hóa học 11
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 11 Bài 8: Amoniac và muối amoni
Bài giảng Hóa 11 Bài 8: Amoniac và muối amoni
A. AMONIAC
I. Cấu tạo phân tử
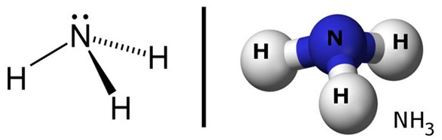
Hình 1: Sơ đồ cấu tạo và mô hình cấu tạo của phân tử NH3.
- Trong phân tử NH3, N liên kết với ba nguyên tử hiđro bằng ba liên kết cộng hóa trị có cực.
- Những đôi electron dùng chung bị lệch về phía nguyên tử N có độ âm điện lớn hơn.
- Phân tử NH3 có cấu tạo hình chóp với nguyên tử nitơ ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên tử H.
- Nitơ còn một cặp electron hóa trị là nguyên nhân gây ra tính bazơ của NH3.
II. Tính chất vật lý
- Amoniac (NH3) là chất khí không màu, có mùi khai và xốc, nhẹ hơn không khí, tan rất nhiều trong nước.
- Ở điều kiện thường, 1 lít nước có hòa tan 800 lít amoniac.
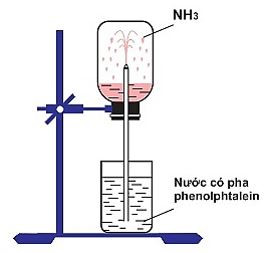
Hình 2: Sự hòa tan của amoniac trong nước
- Hòa tan NH3 vào nước thu được dung dịch gọi là dung dịch amoniac. Dung dịch amoniac đậm đặc thường dùng trong phòng thí nghiệm có nồng độ 25% (D = 0,91g/cm3).
III. Tính chất hóa học
1. Tính bazơ yếu
a) Tác dụng với nước
NH3 + H2O ⇄
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
⇒ Có thể dùng quỳ tím ẩm để nhận biết khí amoniac, quỳ tím ẩm sẽ chuyển thành màu xanh.
b) Tác dụng với dung dịch muối
- Dung dịch amoniac có thể tác dụng với dung dịch muối của nhiều kim loại, tạo thành kết tủa hiđroxit của các kim loại đó.
AlCl3+3NH3+3H2O →Al(OH)3↓+3NH4Cl
Al3++3NH3+3H2O→ Al(OH)3↓+3
c) Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
2. Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại.
a) Tác dụng với oxi
NH3 cháy trong khí oxi cho ngọn lửa màu vàng, tạo ra khí nitơ và hơi nước.
4NH3 + 3O2 2N2 + 6H2O
4NH3 + 5O2 4NO + 6H2O
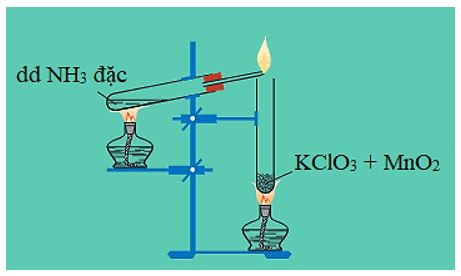
Hình 3: Khí amoniac cháy trong oxi
b) Tác dụng với clo
- Clo oxi hóa mạnh amoniac tạo ra nitơ và hiđro clorua:
2NH3 + 3Cl2 → N2 + 6HCl
- NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl.
NH3 + HCl → NH4Cl
IV. Ứng dụng
- Sản xuất axit nitric, các loại phân đạm như urê (NH2)2CO; NH4NO3; (NH4)2SO4; …

Hình 4: Một số loại đạm
- Điều chế hiđrazin (N2H4) làm nhiên liệu cho tên lửa.
- Amoni lỏng dùng làm chất gây lạnh trong thiết bị lạnh.
V. Điều chế
1. Trong phòng thí nghiệm
- Điều chế bằng cách đun nóng muối amoni (ví dụ NH4Cl) với Ca(OH)2.
Phương trình hóa học:
2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O
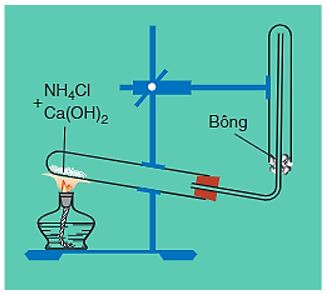
Hình 4: Điều chế khí amoniac trong phòng thí nghiệm
Lưu ý:
- Để làm khô khí, người ta cho khí amoniac vừa tạo thành có lẫn hơi nước đi qua bình đựng vôi sống (CaO).
- Khi muốn điều chế nhanh 1 lượng nhỏ khí NH3, người ta thường đun nóng dung dịch amoniac đậm đặc.
2. Trong công nghiệp
- Tổng hợp từ nitơ và hiđro, theo phản ứng:
N2 + 3H2 2NH3
- Điều kiện áp dụng:
+ Nhiệt độ: 450 – 500oC.
+ Áp suất cao từ 200 – 300 atm.
- Làm lạnh hỗn hợp khí bay ra, NH3 hóa lỏng được tách riêng.
B. MUỐI AMONI
- Là tinh thể ion gồm cation và anion gốc axit.
Thí dụ: NH4Cl (amoni clorua), NH4NO3 (amoni nitrat).
I. Tính chất vật lý
- Tất cả các muối amoni đều tan nhiều trong nước.
- Khi tan trong nước, điện li hoàn toàn thành các ion.
NH4Cl →+ Cl-
1. Tác dụng với dung dịch kiềm
- Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sinh ra khí amoniac.
Thí dụ:
NH4Cl + NaOH NH3↑ + NaCl + H2O
Phương trình ion rút gọn là:
+→ NH3↑ + H2O
→ Phản ứng này để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm.
2. Phản ứng nhiệt phân
Các muối amoni dễ bị phân hủy bởi nhiệt.
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
Thí dụ:
NH4Cl (r)NH3↑ + HCl↑
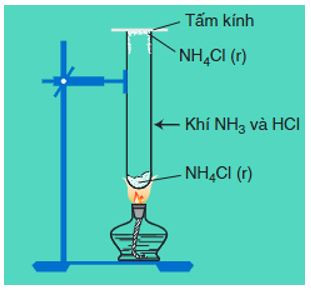
Hình 5: Sự phân hủy của NH4Cl
- Các muối amoni cacbonat và amoni hiđrocacbonat bị phân hủy dần dần ngay ở nhiệt độ thường, khi đun nóng thì phản ứng xảy ra nhanh hơn.
(NH4)2CO3 (r)NH3↑ + NH4HCO3 (r)
NH4HCO3 (r)NH3↑ + CO2↑ + H2O
Lưu ý: NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra N2, N2O.
Thí dụ:
NH4NO2N2 + 2H2O
NH4NO3N2O + 2H2O
⇒ Những phản ứng này được sử dụng để điều chế các khí N2 và N2O trong phòng thí nghiệm.
Trắc nghiệm Hóa 11 Bài 8: Amoniac và muối amoni
Câu 1:
N2(khí)+ 3H2(khí)2NH3; = -92kJ/mol
Trong các yếu tố:
(1) Thêm một lượng N2hoặc H2.
(2) Thêm một lượng NH3.
(3) Tăng nhiệt độ của phản ứng.
(4) Tăng áp suất của phản ứng.
(5) Dùng thêm chất xúc tác.
Có bao nhiêu yếu tố làm cho cân bằng dịch chuyển theo chiều thuận ?
A.3
B.4
C.5
D.2
Đáp án: D
Giải thích:
Các yếu tố: 1, 4.
+ (1): Thêm lượng N2 hoặc H2 → cân bằng dịch chuyển theo chiều làm giảm N2/ H2(chiều thuận)
+ (2): Thêm NH3→ cân bằng dịch chuyển theo chiều làm giảm NH3 (chiều nghịch)
+ (3): = -92 < 0 → phản ứng thuận là tỏa nhiệt → tăng nhiệt độ làm cân bằng chuyển dịch theo chiều thu nhiệt (chiều nghịch)
+ (4): Tăng áp suất của phản ứng → cân bằng dịch chuyển theo chiều giảm áp suất (chiều thuận)
+ (5): Chất xúc tác không làm ảnh hưởng đến cân bằng hóa học
Câu 2: Oxi hoá NH3 bằng CrO3 sinh ra N2, H2O và Cr2O3. Số phân tử NH3 tác dụng với một phân tử CrO3 là
A. 3.
B. 1.
C. 4.
D. 2.
Đáp án: B
Giải thích:
2NH3+ 2CrO3N2+ 3H2O + Cr2O3
→ 1 phân tử NH3 phản ứng với 1 phân tử CrO3.
Câu 3:
A.14,76.
B.18,23.
C.7,38.
D.13,48.
Đáp án: C
Giải thích:
N2 + 3H2 2NH3
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có:
=> H2 thiếu, hiệu suất phản ứng tính theo H2.
Chọn
pư = 3.40% = 1,2 mol
→ pư = 0,4 mol và sinh ra =0,8 mol.
Bảo toàn khối lượng:
→ Tỉ khối của Y với H2 là 7,38.
Câu 4:
A.NO.
B.N2O.
C.HNO3.
D.NH4Cl.
Đáp án: D
Giải thích:
![]()
Câu 5:
A.16,04%.
B.17,04%.
C.18,04%.
D.19,04%.
Đáp án: D
Giải thích:
Dễ thấy hiệu suất tính theo N2
Giả sử X → phản ứng = 1.40% = 0,4 mol
Câu 6:
A.P2O5.
B. H2SO4đặc.
C.CuO bột.
D.NaOH rắn.
Đáp án: D
Giải thích:
Chất dùng làm khô khí NH3 có lẫn hơi nước phải là chất có đặc tính hút nước và không phản ứng với NH3.
→ Dùng NaOH rắn để làm khô khí.
Câu 7:Muối được làm bột nở trong thực phẩm là
A.(NH4)2CO3.
B.Na2CO3.
C. NH4HCO3.
D.NH4Cl.
Đáp án: C
Giải thích: Người ta dùng muối NH4HCO3làm bột nở trong thực phẩm.
Câu 8:
A.Phenol phtalein và NaOH.
B.Cu và HCl.
C.Phenol phtalein;Cu và H2SO4loãng .
D.Quỳtím và dung dịch AgNO3.
Đáp án: D
Giải thích:
- Khi cho quỳ tím vào 3 mẫu thử thì chỉ có NH4Cl làm quỳ tím hóa đỏ. Do hiện tượng thủy phân của NH4Cl:
- Cho AgNO3 vào 2 dung dịch còn lại thì NaCl tạo kết tủa trắng.
AgNO3 + NaCl → AgCl↓ + NaNO3
Câu 9:
(1). NH4NO2
(2). KMnO4
(3). NH3+ O2
(4). NH4Cl
(5). (NH4)2CO3
(6). AgNO3
Số thí nghiệm tạo ra đơn chất là :
A.6
B.5
C.4
D.3
Đáp án: C
Giải thích:
Số thí nghiệm tạo ra đơn chất là (1), (2), (3) và (6).
(1).
(2).
(3).
(4).
(5).
(6).
Câu 10:
A.CO2
B.CO
C.HCl
D.Cl2
Đáp án: A
Giải thích:
Phân urê là (NH2)CO.
Điều chế:
CO2 + 2NH3 (NH2)2CO + H2O