Anonymous
0
0
Lý thuyết Etilen (mới 2024 + Bài Tập) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 9 Bài 37: Etilen
Bài giảng Hóa 9 Bài 37: Etilen
Etilen có công thức phân tử: C2H4
Phân tử khối: 28
I. Tính chất vật lí
Etilen là chất khí, không màu, không mùi, nhẹ hơn không khí ()
và ít tan trong nước.
II. Cấu tạo phân tử
- Trong phân tử etilen mỗi nguyên tử cacbon liên kết với 2 nguyên tử H, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
- Etilen có công thức cấu tạo: 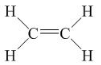 Viết gọn là : CH2 = CH2
Viết gọn là : CH2 = CH2
- Như vậy, trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
Chú ý: Trong liên kết đôi có một liên kết kém bền. Liên kêt này dễ đứt ra trong các phản ứng hóa học.
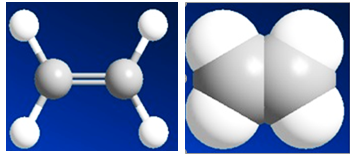
Hình 1: Mô hình phân tử etilen dạng rỗng và dạng đặc.
III. Tính chất hóa học
1) Tác dụng với oxi
- Tương tự như metan, khi đốt khí etilen cháy tạo thành khí CO2, hơi nước và tỏa nhiều nhiệt.
- Phương trình hóa học:
C2H4 + 3O2 2CO2 + 2H2O
1 2 2 mol
Nhận xét: Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol nước.
2) Tác dụng với dung dịch brom
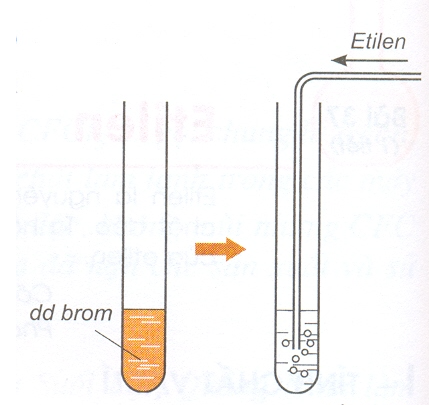
Hình 2: Thí nghiệm etilen tác dụng với dung dịch brom.
- Phương trình hóa học:
Viết gọn: CH2 = CH2 + Br2 (nâu đỏ) → Br – CH2 – CH2 – Br (không màu)
Nhận xét:
– Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom.
– Phản ứng trên gọi là phản ứng cộng. Ngoài brom, trong những điều kiện thích hợp etilen có thể tham gia phản ứng cộng với Cl2, H2, HBr…
– Các chất có liên kết đôi như etilen dễ tham gia phản ứng cộng, làm mất màu dung dịch brom.
3. Các phân tử etilen kết hợp với nhau
- Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác) các phân tử etilen kết hợp với nhau tạo ra chất có kích thước và khối lượng rất lớn gọi là polietilen (PE).
- Phương trình hóa học:
Chú ý:
- Phản ứng trên là phản ứng trùng hợp.
- Polietilen là chất rắn, không tan trong nước, không độc, là nguồn nguyên liệu quan trọng trong công nghiệp chất dẻo.

Hình 3: Một số sản phẩm từ polietilen
IV. Ứng dụng
– Etilen dùng để điều chế axit axetic, rượu etylic, đicloetan, polime (PE, PVC)…
– Etilen dùng kích thích quả mau chín.
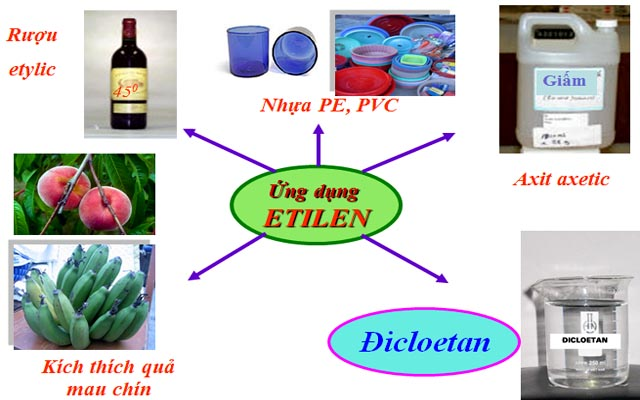
Hình 4: Sơ đồ một số ứng dụng của etilen
Trắc nghiệm Hóa học 9 Bài 37: Etilen
Câu 1:
A. Chất lỏng, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
B. Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
C. Chất khí, không màu, không mùi, ít tan trong nước và nặng hơn không khí.
D. Chất khí không màu, không mùi, tan tốt trong nước và nhẹ hơn không khí.
Câu 2:
A. Điều chế P.E.
B. Điều chế rượu etylic và axit axetic.
C. Dùng để kích thích trái cây mau chín.
D. Điều chế khí gas.
Câu 3:
A. 11,20 lít
B. 12,56 lít
C. 13,44 lít
D. 14,65 lít
Câu 4:
A. một liên kết ba.
B. một liên kết đơn.
C. hai liên kết đôi.
D. một liên kết đôi.
Câu 5:
A. Phản ứng cháy.
B. Phản ứng thế.
C. Phản ứng cộng.
D. Phản ứng phân hủy.
Câu 6:
A. 10,08 lít
B. 13,44 lít
C. 11,56 lít
D. 12,56 lít
Câu 7:
A. Tham gia phản ứng cộng, phản ứng trùng hợp, phản ứng với thuốc tím, phản ứng cháy.
B. Chỉ tham gia phản ứng thế và phản ứng với dung dịch thuốc tím.
C. Chỉ tham gia phản ứng cháy.
D. Chỉ tham gia phản ứng cộng, phản ứng trùng hợp, không tham gia phản ứng cháy.
Câu 8:
A. Nung nóng etan để tách hiđro.
B. Tách từ khí dầu mỏ.
C. Tách nước của ancol etylic.
D. Cracking dầu mỏ.
Câu 9:
A. 80 gam
B. 40 gam
C. 60 gam
D. 50 gam
Câu 10:
A. Etan
B. Metan
C. Axetilen
D. Etilen