Anonymous
0
0
Giải bài tập trang 32 Chuyên đề Hóa 10 Bài 4 - Cánh diều
- asked 6 months agoVotes
0Answers
0Views
Giải bài tập trang 32 Chuyên đề Hóa 10 - Cánh diều
Bài tập 1 trang 32 Chuyên đề Hóa 10: Thả một vài tinh thể patassium dichromate K2Cr2O7 màu cam đỏ vào nước (Hình 4.3). Entropy của quá trình hòa tan này tăng hay giảm? Giải thích.
Trả lời:
Thả một vài tinh thể patassium dichromate K2Cr2O7 màu cam đỏ vào nước, tinh thể patassium dichromate (K2Cr2O7) tan trong nước ⇒ Độ mất trật tự của các ion trong tinh thể tăng ⇒ Entropy của quá trình hòa tan này tăng.
Bài tập 2 trang 32 Chuyên đề Hóa 10: Hãy đánh giá khả năng tự xảy ra của phản ứng sau ở nhiệt độ chuẩn:
2Al(s) + 3H2O(l) → Al2O3(s) + 3H2(g)
Biết rằng: = - 818,3 kJ, được tính theo số liệu cho trong Phụ lục 1. Từ kết quả này hãy đưa ra một số lí do giải thích cho việc vì sao các đồ vật bằng nhôm được sử dụng rất phổ biến.
Trả lời:
= (Al2O3(s)) + 3. (H2(g)) - 2. (Al(s)) - 3. (H2O(l))
= 50,9 + 3.130,7 – 2.28,3 – 3.70,0 = 176,4 J K-1
Ở điều kiện chuẩn T = 298 K
Ta có: = - 298. = -818,3.103 – 298.176,4 = -870867,2 J < 0
rất âm ở điều kiện chuẩn vì thế phản ứng này tự xảy ra.
Các đồ vật bằng nhôm được sử dụng rất phổ biến vì Al phản ứng dễ dàng với H2O ở điều kiện chuẩn để tạo thành lớp màng oxide Al2O3 bền vững. Lớp màng này bảo vệ cho nhôm kim loại chống lại các tác động ăn mòn của môi trường.
Bài tập 3 trang 32 Chuyên đề Hóa 10: Hãy xác định nhiệt độ sôi của CHCl3(l) ở 1 bar và so sánh với giá trị đo được từ thực nghiệm (61,2oC). Giả thiết biến thiên enthalpy và entropy của quá trình không thay đổi theo nhiệt độ.
Biết rằng:
|
(kJ mol-1) |
(J mol-1K-1) | |
|
CHCl3(l) |
-134,1 |
201,7 |
|
CHCl3(g) |
-102,7 |
295,7 |
Trả lời:
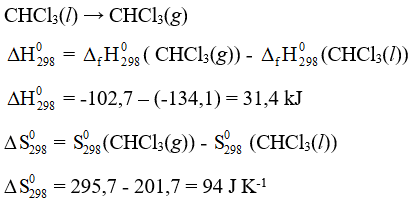
Ở điều kiện chuẩn T = 298 K, 1 bar
Ta có: = - 298. = 31,4.103 – 298.94 = 3388 J
Thực nghiệm T = 61,2 + 273 = 334,2 K
= - 334,2. = 31,4.103 – 334,2.94 = -14,8 J
Thực nghiệm đo được giá trị âm hơn giá trị .