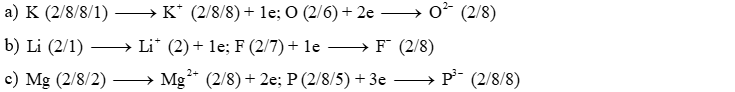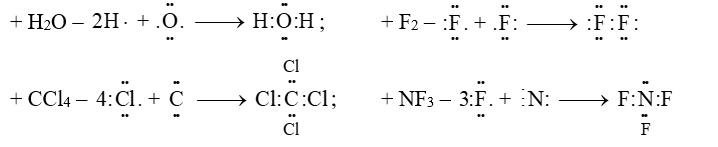Anonymous
0
0
Chuyên đề dạy thêm Hóa 10 Chân trời sáng tạo (2024 có đáp án)
- asked 6 months agoVotes
0Answers
0Views
Chuyên đề dạy thêm Hóa 10 Chân trời sáng tạo (2024 có đáp án)
Chuyên đề Cấu tạo nguyên tử
Chuyên đề Bảng tuần hoàn các nguyên tố hóa học
Chuyên đề Liên kết hóa học
Chuyên đề Phản ứng oxi hóa - khử
Chuyên đề Năng lượng hóa học
Chuyên đề Tốc độ phản ứng hóa học
Chuyên đề Nguyên tố nhóm VIIA – nhóm Halogen
-------------------------------------------------------------
Chuyên đề Liên kết hóa học
A. PHẦN LÍ THUYẾT
I. LÍ THUYẾT TRỌNG TÂM BÀI 8: QUY TẮC OCTET
* Liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
* Quy tắc octet
Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
* Lưu ý:
Không phải mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc octet. Người ta nhận thấy một số phân tử không tuân theo quy tắc octet. Ví dụ: NO, BH3, SF6,…
II. ĐỀ TỰ LUYỆN PHẦN LÍ THUYẾT
2.1. Phần tự luận
Câu 1: Biết phân tử magnesium oxide được hình thành bởi các ion Mg2+ và O2–. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
Câu 2: Cho các nguyên tử của các nguyên tố sau:
Na (Z = 11), Cl (Z = 17), Ne (Z = 10) và Ar (Z = 18).
Những nguyên tử nào trong các nguyên tử trên có lớp electron bền vững?
Câu 3: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Viết số electron theo lớp quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8).
b) Li (Z = 3) và F (Z = 9).
c) Mg (Z = 12) và P (Z = 15).
Câu 4: Cấu hình electron lớp ngoài cùng của nguyên tử potassium (K) là 4s1, cấu hình electron lớp ngoài cùng của nguyên tử bromine (Br) là 4s24p5. Làm thế nào các nguyên tử K và Br có được cấu hình electron của nguyên tử khí hiếm theo quy tắc octet.
Câu 5: Cho một số hydrocarbon sau: H–C≡C–H; H2C=CH2 và H3C–CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
b) Một phân tử hydrocarbon có 3 nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Câu 6: PH3 (phosphine), P2H4 (diphosphine) xuất hiện do sự phân hủy xương, xác động thực vật ở khu vực như đầm lầy, nghĩa địa. P2H4 là chất có khả năng tự cháy trong không khí, khi cháy nó tạo ra nhiệt lượng làm tăng nhiệt độ lên đến khoảng 150 oC sau đó PH3 tiếp tục cháy và kết quả là xuất hiện “ngọn lửa ma trơi”.
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Câu 7: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: H2O, F2, CCl4 và NF3.
Câu 8: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: O2, CO2, CaCl2 và KCl.
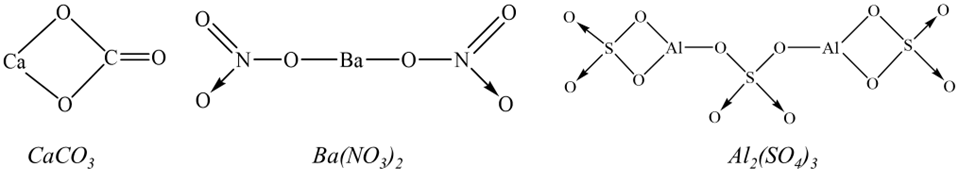
Câu 9: Đá vôi (thành phần chính là CaCO3) được dùng để sản xuất vôi, trong lĩnh vực xây dựng,… Barium nitrate có trong thành phần của kính quang học, gốm, men,… Phèn đơn aluminium sulfate (thành phần chính là Al2(SO4)3) được sử dụng rộng rãi trong xử lí nước thải, trong công nghệ sản xuất giấy, công nghệ nhuộm vải và công nghệ lọc nước và nuôi trồng thủy sản,… Dựa vào quy tắc octet, đề xuất công thức cấu tạo của các chất trên.
Câu 10: Hợp chất X tạo bởi hai nguyên tố A, D có khối lượng phân tử là 76. X là dung môi không phân cực, thường được sử dụng để làm nguyên liệu trong tổng hợp chất hữu cơ chứa sulfur và được sử dụng rộng rãi trong sản xuất vải viscoza mềm. A có công thức hydride dạng AH4 và A có công thức oxide ứng với hóa trị cao nhất dạng DO3.
a) Hãy thiết lập công thức phân tử của X. Biết rằng A có số oxi hóa cao nhất trong X.
b) Đề xuất công thức cấu tạo của X và cho biết các nguyên tử thành phần của X khi liên kết có đủ electron theo quy tắc octet hay không?
2.2. Đáp án phần tự luận
Câu 1: Biết phân tử magnesium oxide được hình thành bởi các ion Mg2+ và O2–. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
Đáp án:
* Mg (Z = 12): 1s22s22p63s2 (có 2 electron lớp ngoài cùng):
* O (Z = 8): 1s22s22p4 (có 6 electron lớp ngoài cùng):
Câu 2: Cho các nguyên tử của các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10) và Ar (Z = 18). Những nguyên tử nào trong các nguyên tử trên có lớp electron bền vững?
Đáp án:
+ Na (Z = 11): 1s22s22p63s1;
+ Cl (Z = 17): 1s22s22p63s23p5;
+ Ne (Z = 10): 1s22s22p6;
+ Ar (Z = 18): 1s22s22p63s23p6.
Nguyên tử Ne và Ar có 8 electron bền vững.
Câu 3: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Viết số electron theo lớp quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8).
b) Li (Z = 3) và F (Z = 9).
c) Mg (Z = 12) và P (Z = 15).
Đáp án:
Câu 4: Cấu hình electron lớp ngoài cùng của nguyên tử potassium (K) là 4s1, cấu hình electron lớp ngoài cùng của nguyên tử bromine (Br) là 4s24p5. Làm thế nào các nguyên tử K và Br có được cấu hình electron của nguyên tử khí hiếm theo quy tắc octet.
Đáp án:
* K (Z = 19): 1s22s22p63s23p64s1 (có 1 electron lớp ngoài cùng):
* Br (Z = 35): 1s22s22p63s23p63d104s24p5 (có 7 electron lớp ngoài cùng):
Câu 5: Cho một số hydrocarbon sau: H–C≡C–H; H2C=CH2 và H3C–CH3.
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet?
b) Một phân tử hydrocarbon có 3 nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Đáp án:
a) Ta có, mỗi gạch trong các công thức biểu diễn hai electron hóa trị chung, do đó mỗi C đã đủ 8 electron ở lớp ngoài cùng; mỗi H đã đủ 2 electron ở lớp ngoài cùng (thõa mãn quy tắc octet).
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H: C3Hx
⇒ Tổng số electron hoá trị là 3.4 = 12.
⇒ Tổng số liên kết đơn giữa các nguyên tử C là: 3 – 1 = 2 ⇒ tổng số electron tham gia tạo liên kết là 2.2 = 4.
⇒ Số H tối đa: x = 12 – 4 = 8.
Câu 6: PH3 (phosphine), P2H4 (diphosphine) xuất hiện do sự phân hủy xương, xác động thực vật ở khu vực như đầm lầy, nghĩa địa. P2H4 là chất có khả năng tự cháy trong không khí, khi cháy nó tạo ra nhiệt lượng làm tăng nhiệt độ lên đến khoảng 150 oC sau đó PH3 tiếp tục cháy và kết quả là xuất hiện “ngọn lửa ma trơi”.
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Đáp án:
Câu 7: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: H2O, F2, CCl4 và NF3.
Đáp án:
Câu 8: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: O2, CO2, CaCl2 và KCl.
Đáp án:
K (Z = 19): 1s22s22p63s23p64s1;
Cl (Z = 17): 1s22s22p63s23p5
;
Câu 9: Đá vôi (thành phần chính là CaCO3) được dùng để sản xuất vôi, trong lĩnh vực xây dựng,… Barium nitrate có trong thành phần của kính quang học, gốm, men,… Phèn đơn aluminium sulfate (thành phần chính là Al2(SO4)3) được sử dụng rộng rãi trong xử lí nước thải, trong công nghệ sản xuất giấy, công nghệ nhuộm vải và công nghệ lọc nước và nuôi trồng thủy sản,… Dựa vào quy tắc octet, đề xuất công thức cấu tạo của các chất trên.
Đáp án:
Câu 10: Hợp chất X tạo bởi hai nguyên tố A, D có khối lượng phân tử là 76. X là dung môi không phân cực, thường được sử dụng để làm nguyên liệu trong tổng hợp chất hữu cơ chứa sulfur và được sử dụng rộng rãi trong sản xuất vải viscoza mềm. A có công thức hydride dạng AH4 và A có công thức oxide ứng với hóa trị cao nhất dạng DO3.
a) Hãy thiết lập công thức phân tử của X. Biết rằng A có số oxi hóa cao nhất trong X.
b) Đề xuất công thức cấu tạo của X và cho biết các nguyên tử thành phần của X khi liên kết có đủ electron theo quy tắc octet hay không?
Đáp án:
- AH4 A thuộc nhóm IVA;
DO3 D thuộc nhóm VIA.
-
a) Công thức phân tử của X: CS2.
b) Công thức cấu tạo của X: . Các nguyên tử C và S đều có 8 electron lớp ngoài cùng theo quy tắc octet.