Anonymous
0
0
TOP 15 câu Trắc nghiệm Ôn tập chương 1 (Kết nối tri thức 2024) có đáp án - Hóa học 10
- asked 6 months agoVotes
0Answers
0Views
Trắc nghiệm Hóa học 10 Bài 4: Ôn tập chương 1 - Kết nối tri thức
Câu 1.
A. [Ne]3s23p4.
B. [Ne]3s23p3.
C. [Ne]3s2.
D. [Ar]4s1.
Đáp án: A
Giải thích:
Nguyên tử sulfur (Z = 16) có cấu hình electron là 1s22s22p63s23p4 hoặc [Ne]3s23p4 hoặc (2, 8, 6).
Câu 2. Nguyên tử X có số hiệu nguyên tử Z = 15. Lớp electron nào trong nguyên tử X có mức năng lượng cao nhất?
A. K.
B. L.
C. M.
D. N.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử X (Z = 15): 1s22s22p63s23p3.
Nguyên tử X có 3 lớp electron Lớp electron thứ ba (n = 3, lớp M) trong nguyên tử X có mức năng lượng cao nhất.
Câu 3.
A. 1s22s22p63s2.
B. 1s22s22p63s23p1.
C. 1s22s22p63s23p2.
D. 1s22s22p63s23p3.
Đáp án: C
Giải thích:
Nguyên tử Y có 3 lớp electron, trong đó lớp ngoài cùng có 4 electron.
Cấu hình electron của nguyên tử Y là: 1s22s22p63s23p2.
Câu 4. Nguyên oxygen có 8 proton và 8 neutron. Kí hiệu của nguyên tử oxygen là
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Đáp án: D
Giải thích:
Nguyên tử oxygen có:
Số hiệu nguyên tử Z = Số proton = 8
Số khối: A = Z + N = 8 + 8 =16.
Kí hiệu của nguyên tử oxygen là ![]() .
.
Câu 5.
A. 6.
B. 8.
C. 12.
D. 18.
Đáp án: B
Giải thích:
Lớp thứ n (n ≤ 4) chứa tối đa 2n2 electron.
Lớp L (n = 2) có số electron tối đa là: 2n2 = 2×22 = 8.
Câu 6.
A. nguyên tố s.
B. nguyên tố p.
C. nguyên tố d.
D. nguyên tố f.
Đáp án: B
Giải thích:
Cấu hình electron của nguyên tử nitrogen (Z = 7): 1s22s22p3.
Electron cuối cùng điền vào phân lớp p nên nitrogen là nguyên tố p.
Câu 7. Số proton, neutron và electron của ![]() lần lượt là
lần lượt là
A. 11, 11, 12.
B. 11, 12, 11.
C. 12, 12, 11.
D. 12, 11, 11.
Đáp án: B
Giải thích:
Số hiệu nguyên tử Z = 11 = Số proton = Số electron
Số khối A = 23 = Z + N ® N = A – Z = 23 – 11 = 12.
Số proton, neutron và electron của ![]() lần lượt là 11, 12, 11.
lần lượt là 11, 12, 11.
Câu 8.
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
Đáp án: B
Giải thích:
![]() :
:
Số hiệu nguyên tử Z = 19 = Số proton = Số electron.
Cấu hình electron của nguyên tử K: [Ar]4s1 Có 1 electron thuộc lớp ngoài cùng.
![]() :
:
Số hiệu nguyên tử Z = 13 = Số proton = Số electron.
Cấu hình electron của nguyên tử Al: [Ne]3s23p1 Có 3 electron thuộc lớp ngoài cùng.
![]() :
:
Số hiệu nguyên tử Z = 17 = Số proton = Số electron.
Cấu hình electron của nguyên tử Cl: [Ne]3s23p5 Có 7 electron thuộc lớp ngoài cùng.
![]() :
:
Số hiệu nguyên tử Z = 8 = Số proton = Số electron.
Cấu hình electron của nguyên tử O: 1s22s22p4 Có 6 electron thuộc lớp ngoài cùng.
Câu 9. Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p3. Số electron trong nguyên tử X là
A. 11.
B. 12.
C. 15.
D. 14.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử X: 1s22s22p63s23p3.
Nguyên tử X có 15 electron.
Câu 10. Nguyên tố magnesium có Z = 12. Nguyên tử magnesium có
A. 3 lớp electron và có 1 electron thuộc lớp ngoài cùng.
B. 3 lớp electron và có 3 electron thuộc lớp ngoài cùng.
C. 2 lớp electron và có 2 electron thuộc lớp ngoài cùng.
D. 3 lớp electron và có 2 electron thuộc lớp ngoài cùng.
Đáp án: D
Giải thích:
Cấu hình electron của nguyên tử magnesium có Z = 12 là 1s22s22p63s2 hoặc [Ne]3s2 hoặc (2, 8, 2).
Nguyên tử magnesium có 3 lớp electron và có 2 electron thuộc lớp ngoài cùng.
Câu 11.
Nguyên tử X: 1s22s22p63s23p5.
Nguyên tử Y: 1s22s22p63s23p64s2.
Phát biểu nào sau đây là đúng?
A. X là nguyên tố kim loại, Y là nguyên tố phi kim.
B. X là nguyên tố phi kim, Y là nguyên tố kim loại.
C. X là nguyên tố khí hiếm, Y là nguyên tố kim loại.
D. X là nguyên tố kim loại, Y là nguyên tố khí hiếm.
Đáp án: B
Giải thích:
Nguyên tử X: 1s22s22p63s23p5.
Nguyên tử X có 7 electron thuộc lớp ngoài cùng ® X là nguyên tố phi kim.
Nguyên tử Y: 1s22s22p63s23p64s2.
Nguyên tử Y có 2 electron thuộc lớp ngoài cùng Y là nguyên tố kim loại.
Câu 12.
A. 5.
B. 4.
C. 3.
D. 2.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử nguyên tố P (Z = 15): 1s22s22p63s23p3 hoặc [Ne]3s23p3.
Cấu hình electron của nguyên tử P có Z = 15: 1s22s22p63s23p3 có thể được biểu diễn theo ô orbital như sau:
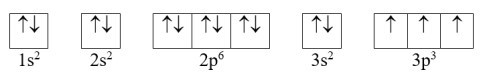
Nguyên tử P có 3 electron độc thân ở trạng thái cơ bản.
Câu 13. Tổng số hạt proton, neutron và electron trong nguyên tử X là 28. Số hạt mang điện nhiều hơn số hạt không mang điện là 8. X là
A. Na.
B. O.
C. F.
D. S.
Đáp án: C
Giải thích:
Nguyên tử X được tạo nên từ hạt proton (p) mang điện tích dương, neutron (n) không mang điện và electron (e) mang điện tích âm.
Trong nguyên tử, số p = số e.
Tổng số hạt proton, neutron và electron trong nguyên tử X là 28.
® 2p + n = 28 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 8.
® 2p – n = 8 (2)
Từ (1) và (2), suy ra: p = 9, n = 10.
Số hiệu nguyên tử Z = số p = 9 ® X là nguyên tố fluorine (kí hiệu F).
Câu 14. Nguyên tố vanadium (V) có 2 đồng vị là ![]() và
và ![]() , trong đó
, trong đó ![]() chiếm 0,25%. Tính nguyên tử khối trung bình của vanadium (V).
chiếm 0,25%. Tính nguyên tử khối trung bình của vanadium (V).
A. 51,2500.
B. 51,9975.
C. 50,9975.
D. 50,2500.
Đáp án: C
Giải thích:
Đồng vị ![]() chiếm: 100% - 0,25% = 99,75% .
chiếm: 100% - 0,25% = 99,75% .
Nguyên tử khối trung bình của vanadium (V) là:
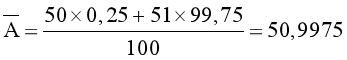
Câu 15. Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 34, trong đó số hạt không mang điện bằng 54,545% số hạt mang điện. Số khối của X là
A. 23.
B. 24.
C. 32.
D. 35.
Đáp án: A
Giải thích:
Nguyên tử X được tạo nên từ hạt proton (p) mang điện tích dương, neutron (n) không mang điện và electron (e) mang điện tích âm.
Trong nguyên tử, số p = số e.
Tổng số hạt proton, neutron và electron trong nguyên tử X là 34.
2p + n = 34 (1)
Số hạt không mang điện bằng 54,545% số hạt mang điện.
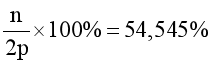 (2)
(2)
Từ (1) và (2), suy ra: p = 11, n = 12.
Số khối của nguyên tử X là: A = Z + N = 11 + 12 = 23.
Các câu hỏi trắc nghiệm Hóa học lớp 10 sách Kết nối tri thức có đáp án, chọn lọc khác:
Trắc nghiệm Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Trắc nghiệm Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học