Anonymous
0
0
Lý thuyết Tính chất hóa học của muối (mới 2024 + Bài Tập) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 9 Bài 9: Tính chất hóa học của muối
Bài giảng Hóa 9 Bài 9: Tính chất hóa học của muối
I. Tính chất hóa học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
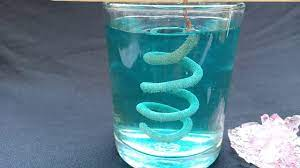
Hình 1: Đồng tác dụng với dung dịch AgNO3
2. Tác dụng với axit
Muối có thể tác dụng được với axit tạo thành muối mới và axit mới.
Ví dụ:
AgNO3 + HCl → AgCl ↓ + HNO3
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với dung dịch muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
AgNO3 + NaCl → NaNO3 + AgCl↓
BaCl2 + K2SO4 → 2KCl + BaSO4 ↓

Hình 2: Dung dịch AgNO3 tác dụng với dung dịch NaCl
4. Tác dụng với dung dịch bazơ
Dung dịch muối có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ:
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4

Hình 3: Dung dịch NaOH tác dụng với dung dịch CuSO4
5. Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ:
2KClO3 2KCl + 3O2 ↑
CaCO3 CaO + CO2 ↑
2KMnO4 K2MnO4 + MnO2 + O2 ↑
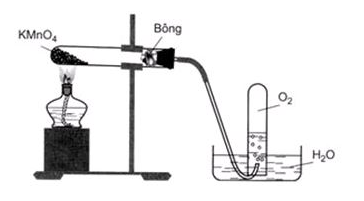
Hình 4: Nhiệt phân KMnO4 để điều chế khí oxi
II. Phản ứng trao đổi trong dung dịch
1. Định nghĩa
Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ví dụ:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Phản ứng không xảy ra.
Chú thích: Phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
Ví dụ:
HCl + NaOH → NaCl + H2O
Trắc nghiệm Hóa học 9 Bài 9: Tính chất hóa học của muối
Câu 1:
A. H2
B. CO2
C. SO2
D. NO2
Câu 2:
A. 26,7 gam
B. 27,6 gam
C. 28,8 gam
D. 29,4 gam
Câu 3:
A. Tác dụng với kim loại
B. Tác dụng với axit
C. Tác dụng với dung dịch bazơ
D. A, B, C đều đúng
Câu 4:
A. 4,89 gam
B. 5,91 gam
C. 6,19 gam
D. 5,45 gam
Câu 5:
A. Có khí thoát ra
B. Xuất hiện kết tủa màu trắng
C. Xuất hiện kết tủa xanh lam
D. Xuất hiện kết tủa màu đỏ nâu
Câu 6:
A. 7,84 lít
B. 6,72 lít
C. 5,56 lít
D. 4,90 lít
Câu 7:
A. KClO3
B. KMnO4
C. CaCO3
D. A, B, C đều đúng
Câu 8:
(1) Muối tác dụng với axit tạo thành muối mới và axit mới.
(2) Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới.
(3) Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
(4) Phản ứng trung hòa không thuộc loại phản ứng trao đổi.
Số phát biểuđúnglà
A. 1
B. 2
C. 3
D. 4
Câu 9:
A. 41,8 gam
B. 42,5 gam
C. 43,2 gam
D. 44.6 gam
Câu 10:
BaCO3+ 2HCl → BaCl2+ Y + H2O
Vậy Y là
A. CO
B. H2
C. Cl2
D. CO2