Anonymous
0
0
Lý thuyết Clo (mới 2024 + Bài Tập) - Hóa học 9
- asked 6 months agoVotes
0Answers
0Views
Lý thuyết Hóa 9 Bài 26: Clo
Bài giảng Hóa 9 Bài 26: Clo
I. Tính chất vật lí
- Clo là chất khí, màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí
( ) và tan được trong nước.
- Ở 20oC, một thể tích nước hòa tan được 20 thể tích khí clo.
- Tác dụng sinh lí: Clo là một khí độc.

Hình 1: Bình chứa khí clo
II. Tính chất hoá học
1. Clo có những tính chất hóa học của phi kim
a. Tác dụng kim loại → muối clorua
- Clo phản ứng với với hầu hết kim loại tạo thành muối clorua
- Ví dụ:
2Fe + 3Cl2 2FeCl3 (sắt(III) clorua)
2Na + Cl2 2NaCl (natri clorua)

Hình 2: Sắt tác dụng với clo
b. Tác dụng hiđro → khí hiđro clorua
- Phương trình hóa học:
H2 (k) + Cl2 (k) 2HCl (k) (khí hiđro clorua)
- Khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit clohiđric.
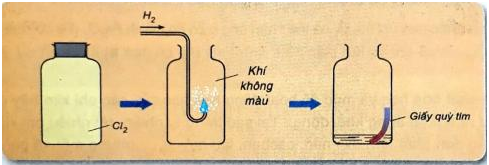
Hình 3: Khí hiđro tác dụng với khí clo.
Chú ý: Clo không phản ứng trực tiếp với oxi.
2. Tính chất hóa học khác của clo
a. Tác dụng với nước
- Phương trình hóa học:
Cl2 (k) + H2O (l) HCl (dd) + HClO (dd)
- Nước clo là dung dịch hỗn hợp các chất Cl2, HCl, HClO có màu vàng lục, mùi hắc.
- Khi cho quỳ tím vào nước clo, lúc đầu dung dịch làm quỳ tím hóa đỏ, sau đó nhanh chóng mất màu do tác dụng oxi hóa mạnh của axit hipoclorơ HClO.
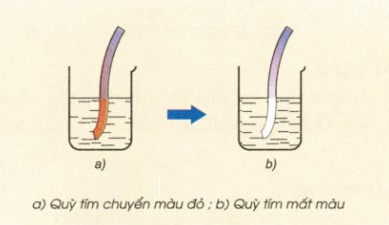
Hình 4: Nhúng giấy quỳ tím vào nước clo
- Nước clo có tính tẩy màu, sát trùng.
b. Tác dụng với dung dịch kiềm (NaOH, KOH, …)
- Khí clo có thể tác dụng với dung dịch kiềm.
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
- Dung dịch hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO) được gọi là nước Gia - ven. Dung dịch này có tính tẩy màu tương tự nước clo, vì NaClO cũng là chất oxi hóa mạnh tương tự HClO.
III. Ứng dụng của clo
- Nước clo dùng khử trùng nước sinh hoạt.
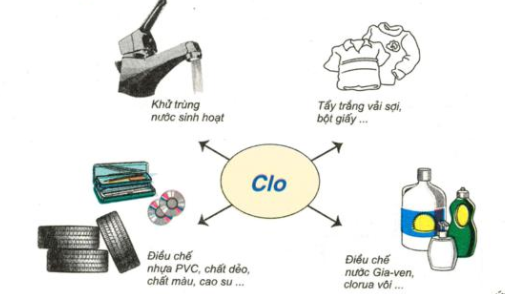
Hình 5: Sơ đồ về một số ứng dụng của khí clo
IV. Điều chế khí Clo
1. Trong phòng thí nghiệm
- Ví dụ:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
- Thu khí clo bằng cách đẩy không khí.
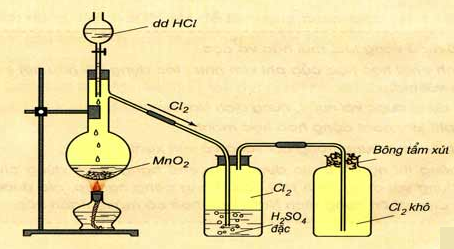
Hình 6: Điều chế clo trong phòng thí nghiệm
2. Trong công nghiệp
Phương pháp Điện phân dung dịch NaCl bão hòa (có màng ngăn xốp ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven)
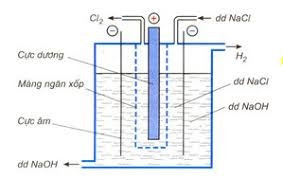 Hình 7: Sơ đồ thùng điện phân dung dịch NaCl
Hình 7: Sơ đồ thùng điện phân dung dịch NaCl
Trắc nghiệm Hóa học 9 Bài 26: Clo
Câu 1:
A. Vàng lục
B. Xanh lục
C. Hồng
D. Tím
Câu 2:
A. Tác dụng với hầu hết kim loại
B. Tác dụng với hiđro
C. Tác dụng với nước, với dung dịch kiềm
D. A, B, C đều đúng
Câu 3:
A. 25%
B. 30%
C. 35%
D. 40%
Câu 4:
A. Nước clo dùng khử trùng nước sinh hoạt
B. Điều chế nước Gia – ven, clorua vôi, tẩy trắng vải sợi, bột giấy
C. Điều chế nhựa PVC, chất dẻo, chất màu…
D. A, B, C đều đúng
Câu 5:
A. H2SO3
B. HNO3
C. HCl đặc
D. H2SO4
Câu 6:
A. 6,72 lít
B. 4,48 lít
C. 5,60 lít
D. 3,36 lít
Câu 7:
A. Dung dịch NaOH
B. Khí O2
C. Dung dịch Ca(OH)2
D. H2O
Câu 8:
A. Chưng cất phân đoạn không khí.
B. Nhiệt phân
C. Thủy phân
D. Điện phân dung dịch
Câu 9:
A. 2M
B. 1M
C. 0,5M
D. 1,5M
Câu 10:
A. NaOH khan
B. CaO
C. Na2SO3khan
D. Dung dịch H2SO4 đặc